神戸大学医学研究科血液内科学分野の片山義雄講師と同分野川野裕子大学院生らの研究グループは、白血病などの治療に欠かせない、末梢血幹細胞採取に用いられるG-CSF製剤による発熱や痛みなどの副反応のメカニズムを解明しました。
G-CSF製剤を用いた末梢血幹細胞採取は、造血細胞移植のもっとも重要な手段となっています。また、同製剤は、血液疾患に対する医療現場のみならず、がん治療の現場でも大変関心の高い薬剤です。しかしながら、その副反応のメカニズムはこれまでほとんど明らかにされておらず、医療現場ではその解明に高い関心が寄せられていました。
本研究の成果は、G-CSF製剤の副反応のメカニズムのみならず、ただ体内に侵入した外敵を食べるだけと思われがちな血液細胞「好中球」の新たな機能をつきとめており、血液細胞が作られ、維持される過程のより深い理解のみならず、よりよい末梢血幹細胞採取の方法につながる可能性が期待されます。
この研究成果は、11月9日 (日本時間) に米国科学雑誌「Blood」にオンライン掲載されました。
研究の背景
近年、白血病をはじめとした造血器悪性疾患の患者数は増加し続けています。「造血幹細胞移植」は、これらの患者に対して血液細胞を産生する「造血幹細胞」を移植し、正常な血液を作ることができるようにする治療法です。
造血幹細胞は、通常は骨髄中に存在していますが、一定の条件下では、末梢血の中に流れ出てきます。末梢血は、血管の中を流れる通常の血液であり、末梢血中に流れ出た造血幹細胞は、採血により採取が可能となります。
G-CSF製剤は、末梢血中に造血幹細胞を動員する作用のある薬剤です。近年では、その安全性からG-CSF製剤による末梢血幹細胞採取が広く用いられるようになってきました。しかし、G-CSFによる末梢血幹細胞動員のメカニズムには不明な点が多く、この方法で十分な幹細胞が採取できないドナー「poor mobilizer」の存在や、発熱や骨痛といった不快な症状にも、十分な説明がつかない状況でした。
ますます需要が増え続けるG-CSFによる末梢血幹細胞採取のメカニズムを正しく理解し、不快な症状と関連した生体内の反応を正しく理解することが、今後の移植医療の発展に大きく寄与すると考えられます。
研究成果
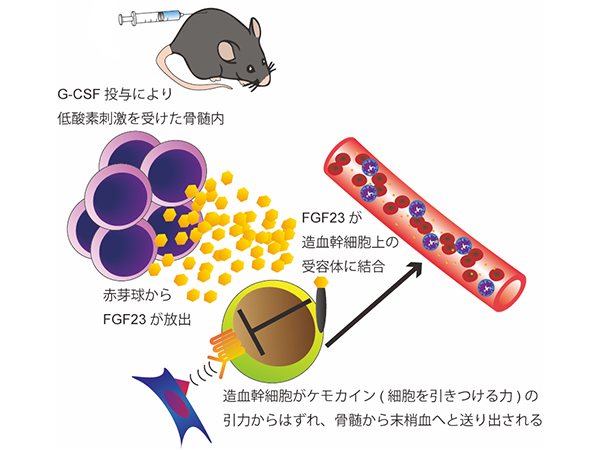
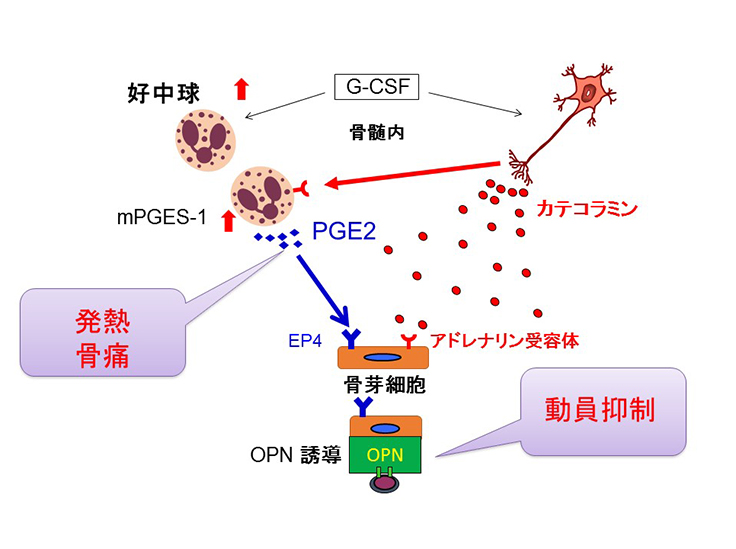
片山講師と川野裕子大学院生らは、G-CSFによる発熱や骨痛に、一般的な消炎鎮痛剤が有効であることに着目しました。消炎鎮痛剤は、炎症や疼痛に関与する「PGE2」の生成を抑制するため、G-CSFにより引き起こされる現象にもPGE2が関与している可能性を考えました。
マウスを用いた実験によりこの仮説の検証を行った結果、PGE2がG-CSFによる末梢血幹細胞動員を妨げる作用をしていることをつきとめ、さらにそのPGE2が血液細胞で作られていることを解明しました。
さらに、血液細胞株を用いた実験で、血液細胞の中でも好中球の仲間に分類される細胞がG-CSFにより高度に引き起こされるストレス刺激(交感神経刺激)に反応してPGE2を産生していることをつきとめ、それが実際に骨髄中の好中球でも起こっていることを確認しました。交感神経が働かないようにしたマウスや、好中球を抗体で除去したマウスの発熱反応を調べ、それらのマウスではG-CSFによる発熱が全く起こらなくなることも示しました。
加えて、PGE2が造血細胞ニッチを構成する細胞のひとつである骨髄中の骨芽細胞に作用して、末梢血幹細胞の動員の妨げとなるオステオポンチン(OPN)という物質を増やし、動員される幹細胞を減らしていることをつきとめました。
今後の展開
今回の研究結果から、G-CSFによる不快な症状は、交感神経刺激を受けた好中球によるPGE2の産生が原因で、それが末梢血幹細胞動員の妨げのひとつになっていることがわかりました。
これらの解明されたメカニズムにより、G-CSFによる不快な症状への正しい対処方法がわかり、さらには現在ではまったく予測不能なpoor mobilizerを予測し、OPN抗体等を用いて対処することができる可能性が示唆されました。
また、交感神経刺激はストレス状況下で引き起こされることから、交感神経が好中球をあやつって炎症物質であるPGE2を産生させることは、ストレスにより体中に散らばる好中球が様々な炎症状態に関与し、発がんやがんの進展、自己免疫疾患や動脈硬化などの進展にも関与している可能性を示唆しています。
論文情報
タイトル
DOI
10.1182/blood-2016-07-725754
著者
Yuko Kawano1, Chie Fukui1, Masakazu Shinohara2,3, Kanako Wakahashi1, Shinichi Ishii1, Tomohide Suzuki1,Mari Sato1,4, Noboru Asada1, Hiroki Kawano1, Kentaro Minagawa1, Akiko Sada1, Tomoyuki Furuyashiki5, Satoshi Uematsu6,7, Shizuo Akira8,9, Toshimitsu Uede10, Shuh Narumiya11, Toshimitsu Matsui12, and Yoshio Katayama1
- Hematology, Department of Medicine, Kobe University Graduate School of Medicine
- The Integrated Center for Mass Spectrometry, Kobe University Graduate School of Medicine
- Department of Community Medicine and Social Health Care, Division of Epidemiology, Kobe University Graduate School of Medicine
- Department of Oral Biochemistry and Molecular Biology, Graduate School of Dental Medicine, Hokkaido University
- Division of Pharmacology, Kobe University Graduate School of Medicine
- Department of Mucosal Immunology, School of Medicine, Chiba University
- Division of Innate Immune Regulation, International Research and Development Center for Mucosal Vaccine, Institute of Medical Science, The University of Tokyo
- Laboratory of Host Defense, WPI Immunology Frontier Research Center (WPI IFReC), Osaka University
- Department of Host Defense, Research Institute for Microbial Diseases (RIMD), Osaka University
- Department of Matrix Medicine, Institute for Genetic Medicine, Hokkaido University
- Department of Drug Discovery Medicine and Medical Innovation Center, Kyoto University Graduate School of Medicine
- Department of Hematology, Nishiwaki Municipal Hospital
掲載誌
Blood (ブラッド)