鳥取大学大学院工学研究科の永野真吾教授、日野智也准教授、藤山敬介氏 (博士後期課程2年) および神戸大学大学院農学研究科の水谷正治准教授らの共同研究グループは、植物の成長に関わるステロイドホルモン「ブラシノステロイド (BR)※1」の生合成において重要な役割を担う酵素「CYP90B1」の立体構造決定に成功しました。植物ホルモンの生合成に関与する膜結合型シトクロムP450 (CYP, P450)※2の立体構造解明は、本研究が世界初となります。
今回の成果は英国の科学雑誌『Nature Plants』で2019年6月10日に掲載されました。
概要
BRは植物ステロールの一種であるカンペステロールを出発材料とし、様々な酵素による触媒反応を経て生合成されます。その初発反応はカンペステロールの22位炭素原子とそれに結合した水素原子との間に一つの酸素原子を挿入する水酸化反応です。22位炭素原子には2つの水素原子が結合しているため、鏡像異性体となる2種類の水酸化型カンペステロールが存在しますが、その片方 ((22S)-OHカンペステロール) のみが生理活性を示すことが知られており、植物が正常に生育するためには、生合成過程でこれらの鏡像異性体を作り分ける精緻な反応制御機構が不可欠です。私たちは、この反応過程を担うCYP90B1について、カンペステロールに類似したコレステロール結合型の構造をX線結晶構造解析※3で決定し、それに基づいた分子シミュレーション手法により、カンペステロールがどのようにこの酵素に結合しているのか、詳細に解析しました。その結果、カンペステロールが持つ24位メチル基が立体障害となり、22位炭素の2つのC-H結合の一つのみに対して酸素添加反応が可能となるため、厳密に片方の鏡像異性体だけが合成される仕組みを明らかにしました。さらに、CYP90B1を標的として植物の成長を制御する農薬分子との複合体の立体構造も決定し、農薬の作用機構を明らかにしました。本研究成果により、CYP90B1の立体構造を基盤とする新規農薬分子の合理的な設計など、農業分野への応用が期待されます。
研究背景
植物は成長過程や環境変化に応じて多様な植物ホルモンを合成し、自身の成長制御や環境ストレス応答を可能にしています。このような植物ホルモンの一つとして知られるブラシノステロイド (BR) は、主に植物の成長の促進を担っており、植物の正常な成長には必要不可欠です。BRは、植物ステロールの一種であるカンペステロールを出発物質とし、その特定の位置に酸素添加反応や還元反応を受けることで生合成されます。これまでにこれらの反応が起こる順序やその反応に関わる酵素はほぼ明らかになっています。BR生合成過程の最初の触媒反応を担うCYP90B1は、その遺伝子欠損が植物の矮小化を引き起こすため、BR生合成の鍵となる大変重要な酵素です。CYP90B1はカンペステロールの22位炭素原子の水酸化反応を触媒しますが、22位炭素原子の2つの水素-酸素原子間 (C−H) の結合のうち厳密に片方のみに酸素原子を挿入し、(22S)-ヒドロキシカンペステロールを特異的に生成することが可能です (図1)。この水酸基の立体特異的な配置は、のちに引き続く生合成過程の進行やBRの生理活性発揮に決定的な影響を与えることから、もう一方のC−H結合に対する反応を起こさない、精密な酸素添加反応の制御が極めて重要です。このような酵素反応の仕組みを解明する上で酵素の立体構造情報は必要不可欠ですが、ブラシノステロイドを含む様々な植物ホルモンの生合成に関与するCYPの構造生物学的研究は、精製酵素の調製や結晶化が困難なためにこれまでほとんど進んでおらず、CYP90B1によるカンペステロールのC22位水酸化反応の立体特異的な制御機構は明らかになっていませんでした。
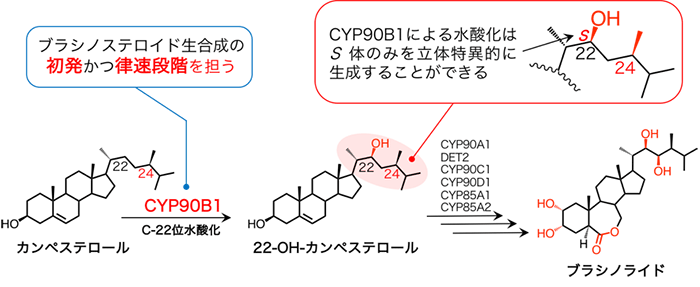
ブラシノステロイド生合成には多くのP450が関わっている。本研究対象のCYP90B1はブラシノステロイド生合成の初発かつ律速段階を担っている。そのため、CYP90B1の阻害剤は植物の成長を制御する農薬としての利用が期待されている。
研究内容・成果
今回、本研究グループはシロイヌナズナ (Arabidopsis thaliana) 由来CYP90B1の結晶化に成功し、X線結晶構造解析によって1種の基質 (コレステロール) 結合型と2種の阻害剤 (ウニコナゾール、ブラシナゾール) 結合型の結晶構造を決定しました。
コレステロールが結合した構造からは詳細な基質の結合様式が明らかとなり、変異体を用いた生化学的な解析を行うことで基質を結合させ、酵素反応を進めるために必須となるアミノ酸残基を特定することができました (図2)。次に、コレステロールが結合した立体構造をもとに、結合エネルギーなどに基づいたドッキングシミュレーションを行うことで、BR生産の出発物質であるカンペステロールが酵素のどの場所へ、どのようなコンフォメーションで結合するのか予測しました。その結果、カンペステロールの22位炭素原子に結合した水素原子のうちpro-S22位の水素原子のみが触媒反応の場であるヘム※4の鉄原子に対し、水酸化可能な距離に配置されることが予測されました。また、カンペステロールの持つ24位炭素原子に結合したメチル基とヘムの間で立体障害が生じることによりステロール側鎖の配向が制限され、22位炭素原子に結合したもう一方のpro-R22位の水素原子が鉄原子に対し水酸化可能な距離まで近接できないために、片方の鏡像異性体のみが選択的に生成されることが分かりました (図3)。
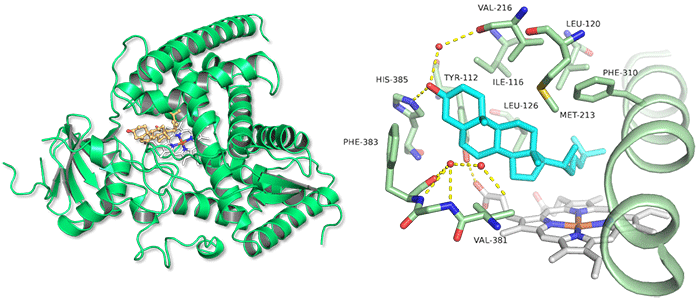
今回明らかにしたCYP90B1の構造は、典型的なP450の「三角プリズム型」の形状をしていた。コレステロール結合型の立体構造から、基質の詳細な結合様式が明らかとなり、CYP90B1の変異体を用いた実験から、Tyr112 (112番目のチロシン) やMet213 (213番目のメチオニン)、His385 (385番目のヒスチジン) が基質の結合に必須の残基であることが明らかとなった。
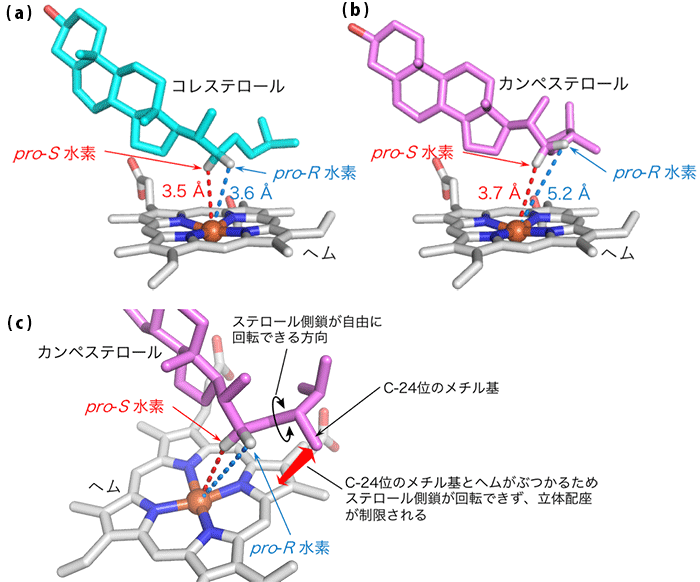
コレステロール結合型の構造から、水酸化を受けるpro-S水素とpro-R水素のヘム鉄までの距離はそれぞれ3.5Å※6と3.6Åであった。これらの距離は実際に水酸化が起こる距離であることが確認されている。一方、予測されたカンペステロールの結合様式ではpro-S水素のみが水酸化可能な距離に位置しており、pro-R水素は明らかに水酸化が困難な距離に位置していた。この結果から、カンペステロールではC-24位メチル基とヘムとの間に生まれる立体障害が原因となり、ステロール側鎖のコンフォメーションが制限されることによって立体特異的な水酸化が可能になっていると考えられる。
また、2つの阻害剤結合型の構造からは、ウニコナゾールとブラシナゾールが類似した化学構造を持つ阻害剤であるにもかかわらず、酵素に結合したそれら阻害剤のコンフォメーションは大きく異なっており、同時にCYP90B1の立体構造も変化していることがわかりました (図4) 。このことから、CYP90B1の基質結合部位付近の構造は、結合する物質に応じてコンフォメーションが変化できる柔軟な可塑性もつことが示されました。
これらの成果は植物ホルモンの生合成に関わる膜結合型P450として世界で最初に構造決定した例であり、また、実際に農薬分子が標的酵素に結合した姿を世界で初めて捉えた例でもあります。本研究成果により、今後は構造生物学的な研究が立ち遅れている植物由来のP450の研究が加速すると期待されます。
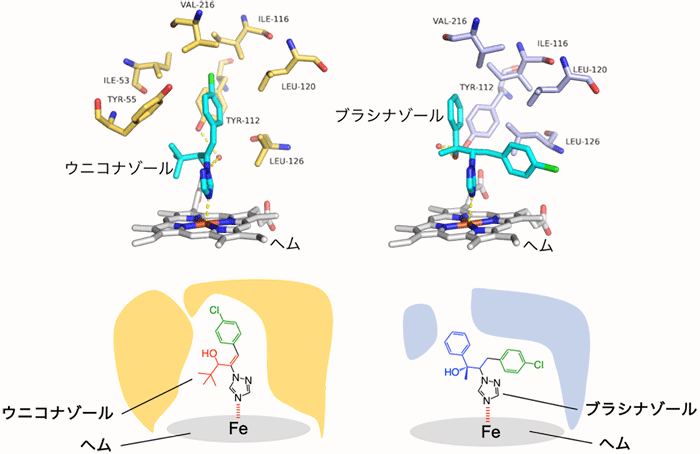
上段は実際の結合様式を示しており、下段は模式図を示している。ウニコナゾールとブラシナゾールは互いに共通の官能基を持っており、構造決定する以前は同様の結合様式によってCYP90B1を阻害すると考えられていた。今回、ウニコナゾール結合型とブラシナゾール結合型の両方の構造を明らかにしたことにより、共通の官能基の一つであるクロロフェニル基 (下段の緑で示した置換基) がおよそ90°傾いていることが明らかになった。今回明らかにした結果は、今後の新規阻害剤の開発には必要不可欠な情報になると考えられる。
今後の展望
ブラシノステロイドの生合成には数種類のP450が関わっており、それらのアミノ酸配列はCYP90B1に対し30%以上同じであることがわかっています。そのため、CYP90B1の結晶構造を鋳型としてブラシノステロイド生合成に関わる各種P450の構造を予測するホモロジーモデリング※5 を実施することが可能となります。これにより、CYP90B1だけでなく他のP450に対する農薬分子の合理的なデザインが可能になり、植物に対する副作用が少なく、安価な新規の農薬の開発が期待できます。また、植物P450の中にはジャガイモ毒のソラニンなどに代表される毒性アルカロイドの生合成に関わる酵素も存在するため、植物毒の生産を抑える農薬の開発につながることが期待されます。
謝辞
本研究は、日本医療研究開発機構 (AMED) の創薬等先端技術支援基盤プラットフォーム (BINDS) の以下の課題により、SPring-8での構造解析に関する支援が行われました。
- 研究課題名・研究代表者
- 「創薬等ライフサイエンス研究のための相関構造解析プラットフォームによる支援と高度化 (SPring-8/SACLAにおけるタンパク質立体構造解析の支援および高度化)」
山本雅貴 (理化学研究所 放射光科学研究センター 部門長)
用語解説
- ※1 ブラシノステロイド
- 植物ホルモンの一種。植物が生産・利用するステロイドホルモンであり、現在、約70種の類縁体が確認されている。植物の伸長成長やストレス耐性などに関わり、極微量で強力な生理活性を示すことが知られている。
- ※2 シトクロムP450 (P450, CYP)
- 活性部位にヘムと呼ばれる色素を持つヘムタンパク質の一種。還元型に一酸化炭素を結合させると450nm付近の波長の光を吸収する特徴から、「P450」という名前がついた。多様な生物で存在が確認されており、薬物代謝やホルモンの生合成、二次代謝産物の生合成・代謝酵素として機能する。
- ※3 X線結晶構造解析
- 単結晶に対してX線を照射することで得られる回折を分析することで、結晶を構成する原子の空間的な座標を決定する手法。タンパク質の立体構造の決定法として有効な手段の一つであり、タンパク質の結晶を作製する必要がある。
- ※4 ヘム
- 2価の鉄原子とポルフィリンから成る錯体。鉄原子に様々な分子種が結合できる性質を持つ。生体内では酸素の運搬を担うヘモグロビンや薬物の代謝を行うP450などがヘムを有しており、ヘムタンパク質が機能するために欠かせない分子種である。ヘムにもいくつか種類が存在し、P450は一般的なヘムbを有している。
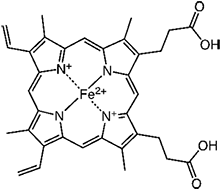
図 ヘムbの構造 - ※5 ホモロジーモデリング
- 構造既知のタンパク質の立体構造を基にして、立体構造が明らかになっていないタンパク質の立体構造をモデリングすること。構造既知のタンパク質に対してある程度の相同性 (アミノ酸配列がどれくらいの割合で一致しているか) を示す場合に用いることができる。
- ※6 Å (オングストローム)
- 長さの単位の一つ。分子や原子の長さを示す時に用いられる。長さは1Å=10-10m。
論文情報
- タイトル
- “Structural insights into a key step of brassinosteroid biosynthesis and its inhibition”
- DOI
- 10.1038/s41477-019-0436-6
- 著者
- 藤山 敬介1, 日野 智也1, 金谷 正弘1, 渡辺 文太2, 李 栄宰3, 水谷 正治3, 永野 真吾1
1 鳥取大学大学院工学研究科
2 京都大学化学研究所
3 神戸大学大学院農学研究科 - 掲載誌
- Nature Plants