神戸大学大学院医学研究科の齊藤泰之講師、小森里美学術研究員、的崎尚特命教授らの研究グループは、免疫反応の司令塔である樹状細胞が、リンパ球の表面に発現するCD47という分子を認識することでリンパ球の生存を制御することを明らかにしました。この発見は、樹状細胞がいかに自己の細胞を認識するかという免疫学の本質的な問いの新たな解明に繋がるとともに、この仕組みを利用した新たな抗がん剤の開発に繋がることが期待されます。
この研究成果は、2023年8月7日 (米国東部時間) 付けで、米国科学誌「Proc. Natl. Acad. Sci. U.S.A. (米国科学アカデミー紀要)」にオンライン掲載されました。
ポイント
- リンパ球の一種であるT細胞のみにCD47分子を欠損させた遺伝子改変マウスでは末梢T細胞の数が著しく減少していた。
- CD47欠損T細胞はネクロトーシスという種類の細胞死によって減少することが明らかとなった。
- この細胞死の機序として、活性化した樹状細胞がT細胞にネクロトーシスを直接誘導することが明らかとなった。
- 本結果により、CD47は末梢組織におけるT細胞の生存を維持することで、アレルギーやがんに対する適切な免疫応答の誘導に重要な役割を担っていることが示された。
研究の背景
私たちの体を病原体から守っている免疫細胞には自分自身 (自己) と病原体 (非自己) を見分ける仕組みが備わっております。中でも、自然免疫細胞の一種である樹状細胞※1は、細胞の表面に発現するさまざまな受容体を介して生体内に侵入した病原体を認識することで病原体を排除する強力な免疫反応が誘導されます。一方で、樹状細胞が自己由来の細胞をどのように認識するのか、さらにはその自己を認識する機構の破綻によって、どのような免疫反応が生じるのかについて、今日まで詳しくは明らかになっていません。
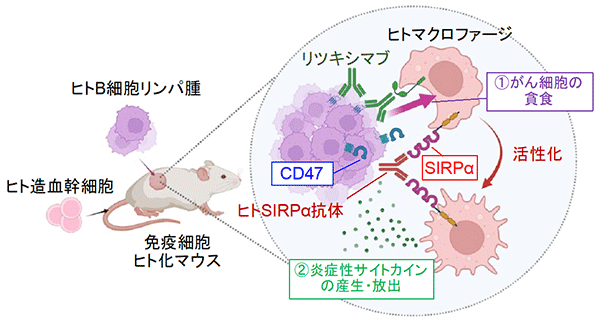
これまでに研究グループは、樹状細胞の表面に発現するSIRPα (サープアルファ)※2と呼ばれる分子を発見し、SIRPαがCD47※3という分子と結合 (細胞間の情報のやり取りを担うCD47–SIRPα系を形成) することで、さまざまな免疫応答に関与することを見出していました。一方、正常な免疫細胞は細胞表面にCD47を発現することで免疫細胞からの攻撃から逃れることが想定されていたものの、その詳しい仕組みについてはこれまで明らかになっていませんでした。
研究の内容
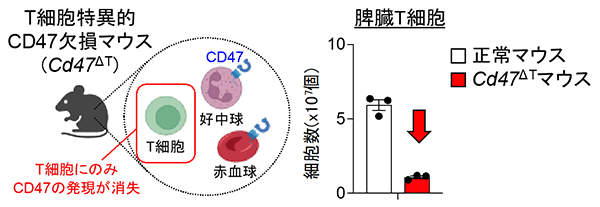
今回研究グループは、免疫応答の中心であるT細胞※4の生存の制御機構に注目しました。T細胞はリンパ球の一種で感染細胞やがん細胞を殺すキラーT細胞や他の細胞による免疫応答を助けるヘルパーT細胞に分けられます。これらのT細胞は脾臓やリンパ節の中に留まっており、樹状細胞から自己や病原体由来の情報を受け取ります。研究グループが、T細胞のみにCD47を欠損させた遺伝子改変マウス※5 (Cd47 ΔTマウス) を作製したところ、脾臓やリンパ節内のT細胞の数が著しく減少していることが分かりました (図1)。

そこで、T細胞の減少の原因を調べるためにCd47 ΔTマウスのT細胞の形態や遺伝子の発現を解析したところ、Cd47 ΔTマウスのT細胞は細胞死の一つであるネクロトーシス※6による細胞死が生じていることが明らかとなりました (図2)。
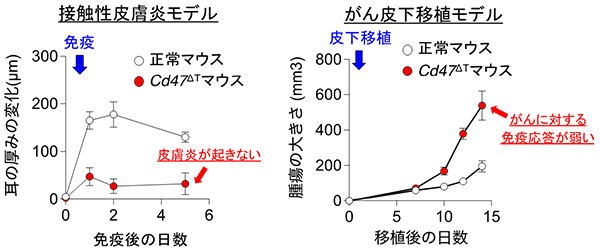
全身性にCD47を欠損させたマウスにおいてはこのようなT細胞特異的な細胞死を認めないことから、T細胞以外の細胞、特に樹状細胞がCd47 ΔTマウスのT細胞に対してネクロトーシスを誘導している可能性が考えられました。実際に樹状細胞とT細胞を共培養したところ、樹状細胞との直接の相互作用によってCD47欠損T細胞に対してネクロトーシスが誘導されることが明らかとなりました。さらに、このT細胞の減少が実際の免疫応答にどのような影響を与えるかを調べる目的で、接触性皮膚炎モデルならびにがんモデルを用いて検討を行いました。その結果、Cd47 ΔTマウスは接触性皮膚炎の発症に抵抗性を示しただけでなく、皮下に移植したがんが著しく増大しました (図3)。
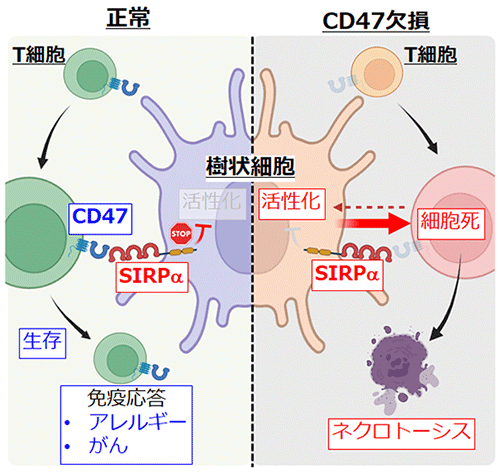
本研究結果により、樹状細胞がT細胞上に発現するCD47を見分けることによって、正常T細胞に対しては生存を、CD47を発現していないT細胞に対しては細胞死を誘導することが分かりました (図4)。この樹状細胞がT細胞の生存を制御することによって、T細胞による適切な免疫応答が誘導されることが今回の研究で示されました。
今後の展開
現在、研究グループはCD47とSIRPαとの相互作用を標的とした新たながん治療薬の開発に取り組んでおります。このCD47–SIRPα系は樹状細胞やマクロファージががん細胞を攻撃する際の分子ブレーキ (免疫チェックポイント) として働くことが判明し、CD47–SIRPα系を標的とした薬剤は現在がんに対する新しい免疫療法として臨床試験が進められております。
今回発見された樹状細胞による細胞死の誘導はこれまで想定されていた機序と全く異なるものであり、今後のCD47とSIRPαを標的とした新規がん治療薬の開発につながる重要な発見であり、現在がん細胞に対しても同様な細胞死の誘導機構を有するかにつきさらに研究を進めております。
用語解説
※1 樹状細胞
白血球の1種であり、外来抗原 (細菌、ウイルス、又は死んだ細胞など) を捕食消化し、消化したこれら外来抗原の一部を未熟なTリンパ球に提示 (情報伝達) することで、Tリンパ球を活性化され、免疫応答を誘導する細胞 (プロフェッショナル抗原提示細胞) である。
※2 SIRPα
細胞の内外を分ける細胞膜上に存在する膜タンパク質の一つで、マクロファージに豊富に存在している。SIRPαはマクロファージの貪食標的となる細胞上の別の膜タンパク質CD47と結合することで、その貪食の活性調節を担っている。SIRPαは、Signal regulatory protein αの略。
※3 CD47
細胞の内外を分ける細胞膜上に存在する膜タンパク質の一つで、すべての細胞膜上に発現しており、自己マーカー分子の一つとしての役割を有すると考えられている。さまざまながん細胞でCD47の発現が増加しており、貪食細胞による排除からの回避に重要であると考えられている。
※4 T細胞
白血球 (リンパ球) の一種で、胸腺(Thymus)でつくられることからT細胞と呼ばれている。樹状細胞などの抗原提示細胞により外来抗原特異的に活性化して、生体内に侵入した外来抗原に対する獲得免疫応答を誘導したり直接排除するために働く。
※5 遺伝子改変マウス
遺伝子工学的技術により人為的に作製された特定の遺伝子に欠損をもつマウス。遺伝子破壊マウスを解析することにより、特定の分子の動物個体レベルにおける未知の機能や疾患との関連が解明できる。
※6 ネクロトーシス
細胞自身が有するプログラムによって引き起こされる細胞死の一種。アポトーシス (自死) とネクローシス (壊死) の両方の特徴を持つことからネクロトーシスと命名された。
謝辞
本研究は、主に日本医療研究開発機構 (AMED) 次世代がん医療加速化研究事業 (P-PROMOTE) ならびに次世代がん医療創生研究事業 (P-CREATE)、JST共創の場形成支援プログラム (COI-NEXT)、科学研究費補助金事業基盤研究 (A)、同事業基盤研究 (C)、ならびに同事業若手研究の支援を受けて実施されました。
論文情報
タイトル
“CD47 promotes peripheral T cell survival by preventing dendritic cell–mediated T cell necroptosis”
(CD47は樹状細胞からのネクロプトーシスの抑制により末梢性T細胞の生存を促進する)DOI
10.1073/pnas.2304943120
著者
小森里美1)2)、齊藤泰之2)*、西村太一2)、Respatika Datu2)、遠藤広美3)、吉田弘樹2)、杉原理沙2)、飯田理恵2)、Afroj Tania1)2)、Oduori Okechi1)2)、仁田英里子3)、小谷武徳2)、村田陽二2)、金子和光4)、仁田 亮3)、大西浩史5)、的崎 尚1)2)*
*共同責任著者
1) 神戸大学大学院医学研究科 生化学・分子生物学講座 生体シグナル制御学部門
2) 神戸大学大学院医学研究科 生化学・分子生物学講座 生化学・シグナル統合学分野 (シグナル統合学)
3) 神戸大学大学院医学研究科 生理学・細胞生物学講座 生体構造解剖学講座
4) 群馬大学大学院医学系研究科 内科学講座 腎臓・リウマチ内科学
5) 群馬大学大学院保健学系研究科 生体情報検査科学講座掲載誌
Proc. Natl. Acad. Sci. U.S.A. (米国科学アカデミー紀要)