神戸大学バイオシグナル総合研究センターの菅澤 薫 教授、東京大学定量生命科学研究所の胡桃坂 仁志 教授、大阪大学大学院基礎工学研究科の岩井 成憲 教授らは、スイスのフリードリッヒ・ミーシャー生物医学研究所等との共同研究で、細胞内で染色体構造を取ったゲノムDNAが紫外線によって損傷を受けたとき、この損傷を効率良く検出して修復を開始するしくみを分子レベルで解明しました。
今後、DNA損傷の速やかな修復を可能にする染色体構造の動的な変化とその制御機構に関する理解が進み、紫外線に対する防護や皮膚がんの抑制などへの応用につながることが期待されます。
この研究成果は、5月29日 (現地時間) に、英国科学雑誌「Nature」に掲載されました。
ポイント
- UV-DDBは紫外線により発生したDNA損傷を見つけ出し、修復を開始することで皮膚がんの抑制に寄与するが、染色体構造の基本構成単位であるヌクレオソーム※上でUV-DDBがどのようにして効率良く損傷を検出するのかはこれまで不明であった。
- 損傷がヌクレオソームの内側に隠れていても、UV-DDBがDNA二重らせんをヒストンタンパク質の表面に沿って「滑らせる」ことで損傷を外側に露出させた上で結合していることが今回初めて明らかになった。
- UV-DDBによるDNA損傷の検出に続き、実際に修復反応を開始するために必要な染色体構造変換の一連のプロセスが今後明らかになることで、紫外線に対する防護や皮膚がんの予防につながる創薬などへの応用が期待される。
研究の背景
ゲノムDNAの損傷は、1日のうち1細胞あたり数万回以上も発生するとされ、修復が間に合わなくなるとDNAの複製・転写の妨害、細胞死や染色体の不安定化を引き起こし、さらには細胞ががん化する恐れもあります。したがって、DNA修復は、細胞が正常な機能を発揮し、生存するために必要不可欠な機能であるといえます。
DNA損傷を引き起こす身近な要因の一つとして紫外線が挙げられます。紫外線によりゲノムDNAが損傷すると、DDB1とDDB2から成るタンパク質複合体(UV-DDB)が損傷を効率良く見つけて結合することで修復の開始を促進します。特にヒトDDB2遺伝子の変異は色素性乾皮症を引き起こし、紫外線による皮膚がんのリスクを著しく高めることが知られています。
紫外線を照射したDNAとUV-DDBを試験管内で混ぜると、非常に効率良く結合することが以前からわかっていました。一方、細胞内でゲノムDNAはヒストンタンパク質の周囲に巻きついて「ヌクレオソーム」と呼ばれる構造を約200塩基対ごとに形成しており、この線維がさらに何重にも折りたたまれて細胞核の中に収納されています。例えば、DNA損傷がヌクレオソームの外側に露出しているか、内側に隠れているかによってUV-DDBの損傷へのアクセスが影響を受けることは容易に想像されます。しかし、ヌクレオソーム内部のDNA損傷の修復を可能にするUV-DDBの機能の詳細はこれまで不明でした。
研究の内容
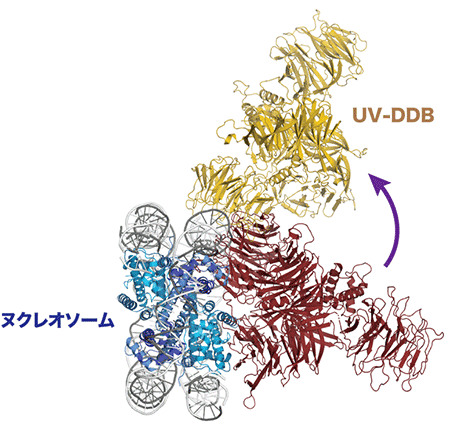
研究グループは、特定の位置に損傷を含むDNAとヒストンタンパク質によってヌクレオソームを形成させ、これにUV-DDBを結合させた複合体の立体構造を低温電子顕微鏡により解析しました。その結果、損傷がヌクレオソームの外側(ヒストンタンパク質の表面から最も遠い位置)に露出している場合には、元のヌクレオソームの構造をほとんど変えずにUV-DDBが損傷に結合できることが確かめられました。
次に損傷の位置を数塩基ずつずらした種々のDNAを用いてヌクレオソームを調製し、同様の解析が行われました。これにより損傷がヒストンタンパク質の表面に向かって次第に近づき、ヌクレオソームの内側に隠れるため、UV-DDBのアクセスに影響を与えるものと予想されました。実際、損傷が元の位置から移動するに従ってUV-DDBの結合が弱まる傾向が見られた一方、そのような条件で形成された複合体の構造を低温電子顕微鏡で解析したところ、驚いたことにヌクレオソーム上でDNAが数塩基分「滑る」ことで、損傷が当初の想定よりもヌクレオソームの外側に向いていることがわかりました。
一般に、DNA損傷はゲノムDNA上の何処で何時発生するか予測することは困難で、修復タンパク質がアクセスしやすいヌクレオソームの外側に損傷が生じるとは限りません。今回の結果は、標的となるDNA損傷がヌクレオソームの内側に隠れている時に、損傷を検出するタンパク質がATP加水分解のエネルギーを使わずにヌクレオソーム側の構造変化を引き起こすことで安定な複合体を形成し、修復反応の開始を可能にするメカニズムを初めて明らかにしたものです。研究グループは、このメカニズムをSlide-Assisted Site-Exposure(SAsSE)と命名しましたが、DNA結合タンパク質がヌクレオソーム上の標的部位をいかに認識して結合するか、DNA修復にとどまらず幅広いゲノム機能の制御を考える上で重要な意義を持つ研究成果といえます。
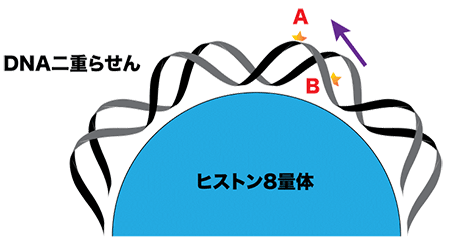
Aの位置に生じた損傷は外側に露出しており、タンパク質が近づきやすい。一方、ヒストンタンパク質の表面に近いBの位置の損傷は内側に隠れており、タンパク質がアクセスしづらいと考えられる。
仮に図1・Bの位置に損傷を持つヌクレオソームにUV-DDBが結合した複合体の構造を予測すると赤色のようになり、両者が衝突してうまく結合できない。しかし、実際に観察された複合体ではDNAがヒストン8量体上を「滑る」ことで損傷がBの位置からAの位置に移動しており、UV-DDBは黄色で示すように結合していた。
今後の展開
UV-DDBがヌクレオソーム上のDNA損傷に結合した上で、実際に修復反応を開始するためにはヒストンタンパク質を解離させ、数多くの修復タンパク質を呼び込むことが必要と考えられています。今回の研究成果はこのような一連のプロセスの詳細な解明において重要な意義を持つもので、その人為的な制御が可能になれば、紫外線に対する防護や皮膚がんの予防につながる創薬などへの応用が期待されます。
用語解説
ヌクレオソーム
真核生物の染色体を構成する基本構造単位で、4種類のヒストンタンパク質(H2A、H2B、H3、H4)2分子ずつから成るヒストン8量体の周囲にDNA二重らせんが約1.75回転巻きついたもの。
謝辞
本研究は、日本学術振興会科学研究費補助金・基盤研究(S)(JP16H06307)、同・新学術領域研究 (JP18H05534)、及びAMED創薬等先端技術支援基盤プラットフォーム (JP18am0101076) の支援を受けて実施されました。
論文情報
タイトル
“DNA damage detection in nucleosomes involves DNA register shifting”
DOI
10.1038/s41586-019-1259-3
著者
Syota Matsumoto1,2, Simone Cavadini1,2, Richard D. Bunker1,2, Ralph S. Grand1,2, Alessandro Potenza1,2, Julius Rabl1,2, Junpei Yamamoto3, Andreas D. Schenk1,2, Dirk Schübeler1,2, Shigenori Iwai3, Kaoru Sugasawa4, Hitoshi Kurumizaka5,6, Nicolas H. Thomä1,2
1 フリードリッヒ・ミーシャー生物医学研究所
2 バーゼル大学
3 大阪大学大学院基礎工学研究科
4 神戸大学バイオシグナル総合研究センター
5 東京大学定量生命科学研究所
6 早稲田大学理工学術院先進理工学研究科掲載誌