神戸大学バイオシグナル総合研究センターの鎌田真司教授、理学研究科生物学専攻の片所諒子博士後期課程学生らの研究グループは、50年以上前に報告された老化細胞が巨大化する現象について、その分子メカニズムと生理的意義の解明に世界で初めて成功しました。加齢とともに体内に蓄積する老化細胞が老化関連疾患の原因となったり、がん治療によって誘発される老化細胞ががんの悪性化やがん治療の副作用の原因となることが示されていることから、体内から老化細胞を除去する方法の開発が求められています。今回の研究成果から、老化細胞の特徴の一つである巨大化が生存維持に働くことが明らかになり、今後、生体から老化細胞を除去するための抗老化薬や抗がん剤の開発に繋がることが期待されます。
この研究成果は、12月7日に「Scientific Reports」に掲載されました。
ポイント
- 老化した細胞の蓄積が、個体老化や老化関連疾患の原因となったり、がんの悪性化やがん治療の副作用の原因となることから、老化細胞を除去することが有効な治療方法となる可能性が示されている。
- 50年以上前に報告された老化細胞が巨大化する分子メカニズムとその生理的意義については、これまで全く不明であったが、今回、巨大化を制御する遺伝子としてネクチン-4を同定し、老化細胞の生存維持に働くことを世界で初めて明らかにした。
- ネクチン-4を標的とした抗ネクチン-4抗体-薬物複合体が開発され、膀胱がん患者の治療のために臨床応用されているが、今後、老化細胞を除去するためにも利用できる可能性があり、新たな抗老化薬や抗がん剤の開発につながることが期待される。
研究の背景
超高齢社会を迎えた日本では、健康で長生きするための老化研究の重要性が高まってきています。私たちの体が老化する仕組みについては不明な点が多いですが、体を作っている細胞の老化が一因ではないかと考えられてきています。ほとんどの細胞は無限に分裂を繰り返すことができず、ある一定を超えると「細胞老化」という分裂不能な状態に陥ります。また、紫外線や放射線、酸化ストレスなどのさまざまなストレスによっても分裂ができなくなり老化状態になることがわかっています。細胞が老化することは、損傷を受けた細胞ががん化して異常増殖することを制限するがん抑制メカニズムであると考えられる一方で、老化細胞は巨大化などの様々な特徴を示しながら、体内に蓄積していくと考えられています。最近の研究から、体内に蓄積した老化細胞はSASP因子※1などを分泌することによって全身の臓器の機能低下を引き起こす有害な作用を持ち、心血管疾患、アルツハイマー病、糖尿病などの加齢により発症しやすくなる老化関連疾患の原因となったり、がんの増殖や悪性化を促進するなどの負の側面を持つことも知られています。実際にマウスを用いた実験では、個体から老化細胞を除去することによって老化関連疾患やがんが抑制されたり、寿命が延びるなどの結果が報告されています。つまり、体内から老化細胞を除くことができれば、老化関連疾患の治療や寿命の延伸、がんの治療などに繋がることが期待され、老化細胞を殺すための薬剤 (セノリティック薬と呼ばれる) の開発に向けた研究が世界中で精力的に行われています。
研究グループは、老化細胞で特異的に高発現する遺伝子を見つけることがセノリティック薬の開発に繋がるのではないかと考え、網羅的な解析によって老化細胞で発現上昇する遺伝子を複数同定することに成功してきました注1。そのうちの一つが、今回解析を行ったネクチン-4という遺伝子です。ネクチンは、ネクチン-1、ネクチン-2、ネクチン-3、およびネクチン-4の4種類が同定されており、カルシウム非依存的に細胞接着に関与し、細胞の移動、生存、分化などのさまざまな細胞機能を制御します。ネクチン-1および-2が組織で広く発現しているのに対し、ネクチン-4は主に胎盤と気管で発現していることが示されていますが、研究グループは、老化の誘導と確立に重要な働きをする転写因子であるp53※2に依存して、老化細胞で特異的に発現上昇することを明らかにしていました。一方、老化細胞はさまざまな特徴的な形態変化を示すことが知られており、最も典型的な特徴が細胞の巨大化です。この特徴は1960年代に報告されましたが、現在に至るまでその分子メカニズムと生理的意義については、全く未解明のままでした。今回の研究では、世界で初めてネクチン-4が老化細胞の巨大化を制御し、さらには老化細胞の生存に寄与することを明らかにしました。
注1 2016年9月5日神戸大学プレスリリース「細胞老化を制御する遺伝子の同定に成功-抗がん剤治療・アンチエイジング製品開発等への貢献の可能性-」
研究の内容
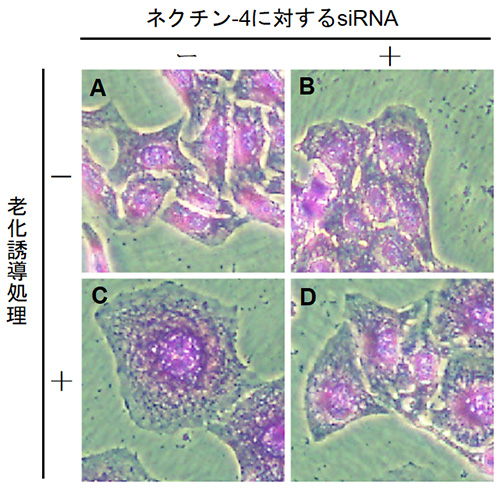
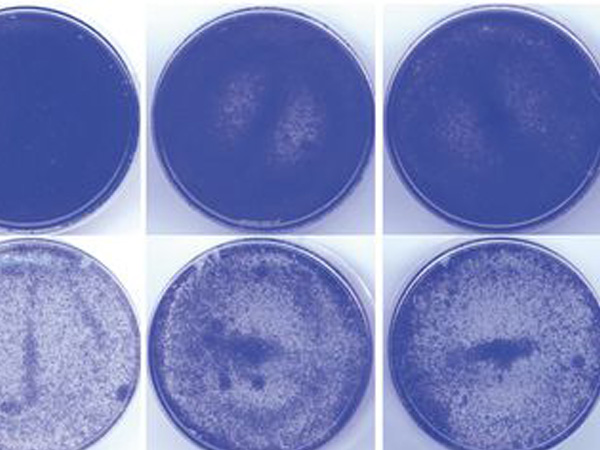
研究グループでは、まずDNAに損傷を与える抗がん剤であるエトポシドを用いて、細胞を低濃度で処理することによって細胞老化を誘導する実験系を確立しました。細胞老化を誘導すると、明らかな細胞サイズの巨大化が観察できます (図1)。この時、siRNA※3を用いてネクチン-4をノックダウンすると巨大化が抑制されたことから、老化細胞の巨大化にはネクチン-4が必須であることが分かります。また、ネクチン-4を過剰発現させると、老化誘導処理を行わなくても老化細胞によく似た巨大化した細胞形態を示しました (図2)。これらのことから、老化細胞ではネクチン-4の発現が上昇することによって、細胞の巨大化に繋がることが明らかになりました。
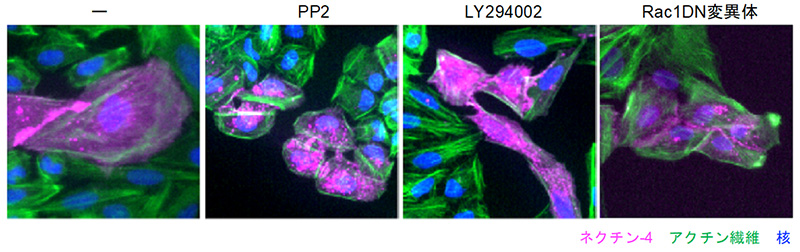
次に、ネクチン-4がどのようなシグナル伝達経路を介して細胞の巨大化を制御しているのかを検討しました。ネクチン-4の過剰発現によって誘導された細胞の巨大化が、PP2 (Srcファミリーキナーゼ※4の阻害剤) とLY294002 (PI3キナーゼ※5の阻害剤) 処理によって抑制されることが分かりました (図3) 。さらには、PI3キナーゼの下流で機能するRac1※6のドミナントネガティブ変異体※7の過剰発現によっても細胞の巨大化が抑制されました。以上のことから、ネクチン-4から細胞の巨大化に至る経路は、Srcファミリーキナーゼ/PI3キナーゼ/Rac1シグナル伝達経路を介することが明らかになりました。
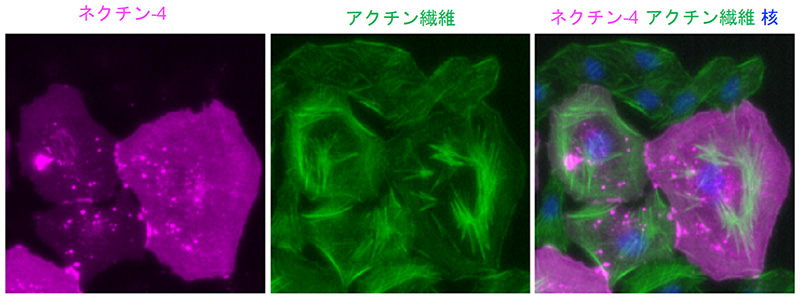
最後に、老化細胞が巨大化する生理的意義について解析を行いました。細胞に老化誘導する際、siRNAによってネクチン-4をノックダウンし、タイムラプス観察によって個々の細胞の運命を追跡すると、明らかな生存率の低下が認められたことから、細胞サイズと生存率の間に強い正の相関関係があることが明らかになりました。そして、この生存率の低下はアポトーシス※8が起こることによるものであることが分かりました。
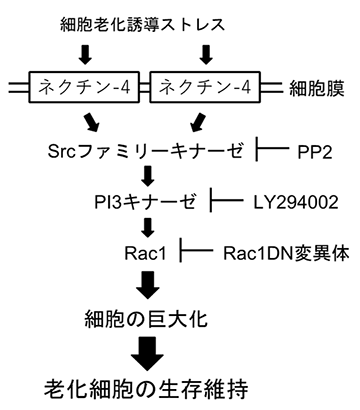
以上のことから、種々のストレスにより細胞老化が誘導されるとp53依存的にネクチン-4が発現誘導され、細胞膜に局在するネクチン-4は、Srcファミリーキナーゼ、PI3キナーゼ、Rac1を介してシグナルを伝達し、細胞サイズを巨大化させ、その結果、老化細胞の生存が維持されることを解明しました (図4)。
今後の展開
様々なストレスによって誘導され加齢とともに体内に蓄積する老化細胞や、がん治療などによって誘導される老化細胞は、いずれも体内で生存を維持し、SASP因子を分泌することにより、周辺細胞を障害したりがんの悪性化を促進することが知られています。これまで、老化細胞の生存維持メカニズムについてはほとんど不明でしたが、今回の解析により、ネクチン-4依存的に細胞サイズを巨大化することによって生存を維持する可能性が示唆されました。ネクチン-4から細胞の巨大化に至る経路を阻害することによって老化細胞を除去することができれば、老化関連疾患の治療や寿命の延伸、がんの治療などに繋がるかもしれません。
一方、ネクチン-4は、膀胱がん、乳がん、卵巣がん、肺がんなどのさまざまな種類のがんで高い発現を示し、がんの予後不良と関連することが報告されていることから、ネクチン-4はがん細胞のサイズの制御を通じてがんの悪性化にも寄与する可能性があります。これまでに、抗がん剤を付加した抗ネクチン-4抗体-薬物複合体 (エンフォルツマブ ベドチン) が開発され、膀胱がん患者の治療のために臨床応用されており、老化細胞を除去するためにも利用できるかもしれません。今回の研究結果は、ネクチン-4がSrcファミリーキナーゼ/PI3キナーゼ/Rac1シグナル伝達経路を介して、老化細胞のサイズ拡大と生存維持に関与していることを明らかにしており、今後、この経路を標的にすることによって、老化関連疾患の治療薬や寿命を延伸するサプリメント、がんの治療薬などが開発される可能性があります。
用語解説
※1 SASP因子
SASP (Senescence-Associated Secretory Phenotype) とは細胞老化随伴分泌現象のことであり、分泌されるタンパク質群がSASP因子と総称される。SASP因子には、サイトカイン、ケモカインなどのさまざまな炎症性タンパク質やマトリックスメタロプロテアーゼなどが含まれ、周辺の正常細胞の機能に影響を与える。
※2 p53
がん抑制活性を持つ転写因子であり、DNA損傷などのストレスによって活性化し、細胞周期の停止、細胞死、細胞老化などを誘導する。
※3 siRNA
small interfering RNAの略。21-23塩基対から成る低分子二本鎖RNA。 siRNAはRNA干渉に関与し、伝令RNA (mRNA) の破壊によって配列特異的に遺伝子の発現を抑制する。
※4 Srcファミリーキナーゼ
細胞質チロシンキナーゼのファミリーで、チロシンキナーゼ活性を持たない細胞表面受容体の細胞質領域と結合し、受容体自身や他の細胞内シグナルタンパク質をリン酸化してシグナル伝達を進める。
※5 PI3キナーゼ
ホスファチジルイノシトール3キナーゼの略であり、膜の構成成分であるイノシトールリン脂質のイノシトール環3位のリン酸化を行う酵素である。プロテインキナーゼB (PKB) /Aktを活性化することにより、様々な生理作用の発現に関与する。
※6 Rac1
低分子量GTP結合タンパク質のRASスーパーファミリーに属するGTPaseであり、細胞増殖の制御、細胞骨格再構築およびプロテインキナーゼの活性化を含む多種多様な細胞事象を調節する。
※7 ドミナントネガティブ変異体
正常な遺伝子産物 (タンパク質) に対してドミナント (優位) に働き、正常タンパク質の機能を阻害する (ネガティブな効果) 変異体。
※8 アポトーシス
細胞が持つ遺伝的プログラムによって自らを死に導く細胞死の形態の1つ。カスパーゼというタンパク質切断酵素群の働きにより誘導される。
謝辞
本研究は、JSPS科研費 (25640063、17K15595、20K07591、20K15791、21K05308)、上原記念生命科学財団、株式会社リバネス、ひょうご科学技術協会学術研究助成 (#4067)、およびJST次世代研究者挑戦的研究プログラム (JPMJSP2148) の助成を受けて実施しました。
論文情報
タイトル
“ Nectin-4 regulates cellular senescence-associated enlargement of cell size ”
DOI
10.1038/s41598-023-48890-z
著者
Ryoko Katasho1 (片所諒子), Taiki Nagano2 (長野太輝), Tetsushi Iwasaki1,2 (岩崎哲史), Shinji Kamada1,2 (鎌田真司)
1 神戸大学大学院理学研究科生物学専攻
2 神戸大学バイオシグナル総合研究センター掲載誌
Scientific Reports