神戸大学大学院理学研究科の酒井友希特命講師、石崎公庸教授、深城英弘教授らと、京都大学大学院生命科学研究科の山岡尚平准教授、愛媛大学大学院理工学研究科の加藤大貴准教授らの研究グループは、モデル植物ゼニゴケ(Marchantia polymorpha)*1において、繁殖に関わる器官の形成を制御する鍵転写因子*2SHOT GLASSを発見し、その働きを明らかにしました。
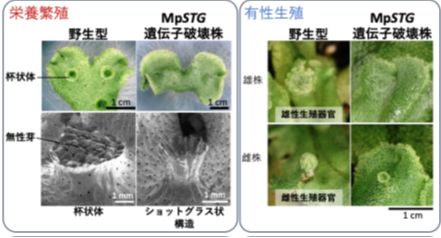
ゼニゴケは栄養繁殖*3と有性生殖*4により繁殖します。栄養繁殖では杯状体とよばれる栄養繁殖器官が、有性生殖では雌雄の有性生殖器官が形成されますが、いずれも器官形成のメカニズムは明らかになっていませんでした。そこで、研究グループは、器官形成に関与すると思われるゼニゴケの転写因子SHOT GLASS(MpSTG) 遺伝子に着目したところ、MpSTG遺伝子の破壊株では、栄養繁殖器官である杯状体が全く形成されず、ごく稀にショットグラス状の構造が形成されました(図1)。また、MpSTG遺伝子破壊株では雌雄の有性生殖器官も形成されませんでした。このことから、MpSTGがゼニゴケの栄養繁殖だけでなく有性生殖の器官形成にも必須の機能をもつことが明らかとなりました。さらに、MpSTGが被子植物シロイヌナズナ*5が芽を増やすための制御因子と共通した起源をもつことも明らかになり、器官形成の遺伝子制御ネットワークが陸上植物において進化的に保存されている可能性を示唆しました。
今後、MpSTGがどのような遺伝子を制御しているのかを明らかにすることで、農業やバイオものづくり分野において、植物を効率よく増やすための技術の改良に貢献できると期待されます。この研究成果は、7月30日14時00分(日本時間)に、New Phytologist 誌に掲載されました。
ポイント
- 植物の栄養繁殖メカニズム解明を目指し、コケ植物のゼニゴケをモデルとして栄養繁殖器官(杯状
体)と有性生殖器官、両方の形成に必須の鍵転写因子SHOT GLASS(MpSTG)を発見した。 - 転写因子MpSTG を欠損すると、杯状体が形成されず、代わりに不完全な「ショットグラス状構
造」がごく稀に形成され、栄養繁殖できなくなる。 - 転写因子MpSTG を欠損すると、雌雄の有性生殖器官も形成不能となる。
- ゼニゴケのMpSTG は、被子植物シロイヌナズナの脇芽形成因子AtLOF1 と機能的に類似している
ことが示され、繁殖に関わる器官形成の遺伝子制御ネットワークが陸上植物間で進化的に保存さ
れている可能性が示唆された。 - 本研究成果は、農業やバイオものづくり分野でのバイオマス増産や繁殖制御の応用につながると
期待される。
研究の背景
ジャガイモの塊茎やキクのさし芽などのように、幹細胞を持つ植物体の一部が切り離されて増殖する栄養繁殖は、我々人類にとっては農業や園芸の分野で欠かせない植物の繁殖の仕組みです。しかし栄養繁殖の様式は多岐にわたり、栄養繁殖をしない植物もあるため、栄養繁殖の分子メカニズムについての知見は限られていました。コケ植物ゼニゴケ(Marchantia polymorpha)は、庭園で繁茂して園芸家に嫌われるほど強く旺盛に繁殖します。ゼニゴケがこのように旺盛に繁殖できるのは、ゼニゴケが栄養繁殖の仕組みをもっているからなのです。ゼニゴケは植物体に杯状体というカップ状の栄養繁殖器官を形成し、その中にクローン個体である無性芽を大量につくります。この大量の無性芽は、雨風によってあるいは動物の体に付着して周囲に散らばり、そこで植物体へと成長します。
さらに、ゼニゴケには雄株と雌株があり、それぞれで有性生殖器官が形成されて、雨水によって精子が卵に到達して受精すると胞子体が形成されます。胞子体では数万個に及ぶ胞子が作られ、風に乗って遠くまで散らばって、次世代の植物が成長します。ゼニゴケは季節的な環境の変化に合わせて栄養繁殖と有性生殖の両方の繁殖モードを使い分けて、巧みに増殖しています。
ゼニゴケが属するコケ植物は、陸上植物の進化の過程で最も古い時代に分岐した系統だと考えられています。しかし近年、植物にとって重要な発生や環境に対する応答などの仕組みの多くが、コケ植物と他の陸上植物で共通しているということがわかってきました。ゼニゴケは遺伝子の操作が容易で、成長が速く、全ゲノム配列情報が解読されているという、研究材料としての利点があります。そこで私たちはゼニゴケを利用して栄養繁殖の仕組みの一端を明らかにできるのではないかと考えて研究を進めてきました。
研究の内容
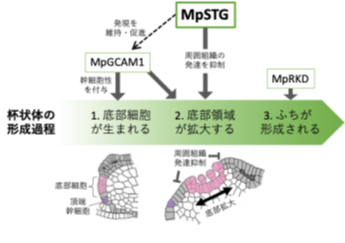
ゼニゴケの栄養繁殖器官である杯状体は、頂端幹細胞の近くの表皮細胞から形成されます。表皮細胞が杯状体底部細胞としての性質をもつようになり、底部細胞の一部の細胞が無性芽を形成し始めます。次に底部細胞が分裂により増殖して底部領域が拡大していきます。最後に周囲の組織が立ち上がって、杯状体のふちが形成されると考えられています。
れまでに、杯状体の形成開始にMpGCAM1という転写因子が必須であることがわかっていました(Yasui et al., 2019)。MpGCAM1は細胞に幹細胞としての性質を与える役割があると考えられており、MpGCAM1遺伝子が欠損すると杯状体が全く形成されなくなります。私たちは、MpGCAM1と同様に杯状体で発現*6する転写因子に着目しました。その転写因子の遺伝子を破壊すると、杯状体が形成されなくなりました。しかし、ごく稀にショットグラス状の構造が杯状体の代わりに形成されることがありました(図1)。そこでこの転写因子をSHOT GLASS(MpSTG)と名付けました。
様々な解析から、ショットグラス状の構造は底部領域を欠損した“杯状体のなりそこない“であることが示されました。ショットグラス状構造ではMpGCAM1が発現しておらず、MpSTGはMpGCAM1の発現を維持または促進していることが示唆されました(図2)。さらにMpSTGは周囲の組織の発達を抑制することにより杯状体底部領域の拡大を助けている可能性が見えてきました(図2)。
興味深いことにMpSTGの遺伝子破壊株では、雌雄の有性生殖器官も形成されないことがわかりました(図1)。ゼニゴケの有性生殖器官は、日本では日の長さが長くなる夏の時期に形成されます。季節の変化を感じ取り、有性生殖モードに切り替わると、MpBONOBOという転写因子が働き始めることがわかっています(Yamaoka et al., 2019)。MpSTGが無いと、MpBONOBOが働けなくなることがわかりました。これらのことから、MpSTGは栄養繁殖器官だけでなく、有性生殖器官の形成過程でも機能していることが示されました。
MpSTGはR2R3-MYB転写因子ファミリーのサブファミリーVというグループに属する転写因子です。多くの作物が属する被子植物も同じグループの転写因子を持っています。被子植物のトマトやシロイヌナズナでは、このグループの遺伝子が脇芽の形成に必要であることがわかっています(Naz et al., 2013; Lee et al., 2009)。植物は茎の先端(茎頂)に幹細胞群を持っています。脇芽というのは、茎頂から離れた場所(葉の付け根)に新たに作られる幹細胞群です。シロイヌナズナのR2R3-MYB転写因子ファミリーのサブファミリーVの一つであるLATHERAL ORGAN FUSION 1(AtLOF1)遺伝子を破壊した植物では、脇芽に異常が見られます。私たちはMpSTGがこの異常を一部回復できることを明らかにしました。これらのことから、R2R3-MYB転写因子ファミリーのサブファミリーVの転写因子が、コケ植物と被子植物で共通した分子機能を持っていること、ゼニゴケの無性芽やシロイヌナズナの脇芽のように頂端の幹細胞群から離れた場所に幹細胞を持つ器官を作り出す過程で機能していることが示唆されました。
今後の展開
本研究は、ゼニゴケを用いて、栄養繁殖および有性生殖の両方における鍵制御因子MpSTGの存在とその制御ネットワークを解明した初めての成果です。これにより、陸上植物における繁殖制御の基本メカニズムとその進化的起源に迫る重要な手がかりが得られました。
今後は、MpSTGがどのような遺伝子の発現を制御しているのかといった下流の分子ネットワークをさらに詳細に解析することで、器官特異的な細胞分化や増殖制御の仕組みが明らかにできると期待されます。また、ゼニゴケ以外のコケ植物やシダ植物を対象とした比較解析を進めることで、陸上植物の器官多様性とその進化的背景を解き明かすことも可能となります。
さらに、本研究成果は、植物の栄養繁殖の制御や生殖調節技術の開発、将来的には農作物における繁殖戦略の改良やバイオマス生産の効率化にも応用できると期待されます。
用語解説
※1 ゼニゴケ(Marchantia polymorpha)
ゼニゴケは北半球を中心として世界中に広く分布し、日本でもごく一般的に植え込みや庭のすみに自生しており、中学校の理科の教科書に苔類の例として取り上げられるなど、身近な植物の一つです。ゼニゴケは陸上植物進化の最も初期に分岐したコケ植物に属しています。従って、コケ植物において被子植物と共通した分子メカニズムが明らかになれば、それは陸上植物の共通祖先において既に獲得されていた分子メカニズムであると考えることができます。2017年には 日本産の標準系統雄株 (Takaragaike-1) の全ゲノム配列が解読され、他の陸上植物系統と共通した遺伝子が保存されていること、遺伝子の冗長性が比較的低いことがわかりました(Bowman et al. 2017)。研究室での培養や、遺伝子改変が容易であることから、ゼニゴケはコケ植物のモデル植物として国内外を問わず多くの研究に利用されています。
※2 転写因子
ある遺伝子の制御領域に結合して、その遺伝子の転写を制御(促進・抑制)する因子。
※3 栄養繁殖
植物体の一部が分離して繁殖する無性生殖様式の一つ。遺伝的には親個体と同一のクローンが生み出されます。栄養繁殖の例としては、茎に由来する塊茎や地下茎、匍匐枝、根に由来する塊根、芽に由来する無性芽などがあります。
※4 有性生殖
異なる性の配偶子(精子と卵)が融合して、新しい遺伝子の組み合わせを持つ次世代を生み出す生殖様式。遺伝的多様性が生まれ、親とは異なる遺伝的特徴を持つ個体ができるので、種として環境変化に対する適応力が高まるという利点があります。
※5 シロイヌナズナ(Arabidopsis thaliana)
被子植物アブラナ科の一年草。植物体のサイズが小さく、研究室での栽培が容易であり、2000年には全ゲノム配列が解読されたことから、モデル植物として植物研究の材料に広く使われています。
※6 発現
ゲノム上にある遺伝子の情報が実際に細胞内で働くために、RNAやタンパク質が作られる過程を指します。DNAの中にある遺伝子の情報に基づいてメッセンジャーRNA(mRNA)がつくられる過程を「転写」といい、そのmRNAの情報からタンパク質が合成される過程を「翻訳」と言います。この一連の流れが遺伝子発現です。つまり、「ある遺伝子が高発現する」という場合は、その遺伝子からたくさんのmRNAが作られ、結果的にその働きを持つタンパク質が多く合成されている状態を意味します。逆に、発現が抑制されるというのは、その遺伝子からmRNAがあまり合成されずタンパク質もほとんど作られない状態のことです。
謝辞
本研究は以下の研究助成を受けて行われました。
- 文部科学省 科学研究費補助金「新学術領域研究」(19H05673, 19H05670)
- 日本学術振興会(JSPS)科研費(KAKENHI)(25119711, 15H01233, 17H06472, 21K15125, 20H05780, 21J40092, 25K09689, 15H04391,19H03247)
- GteXプログラム(JPMJGX23B0)
- 地域中核・特色ある研究大学強化促進事業(J-PEAKS)
- SUNTORY研究助成
- 山田科学財団
- 旭硝子財団
論文情報
タイトル
DOI
10.1111/nph.70337
著者
Yuuki Sakai1, Hideyuki Takami1, Shohei Yamaoka2, Hirotaka Kato1,3, Hidehiro Fukaki1, Takayuki Kohchi2, Kimitsune Ishizaki1
1 Graduate School of Science, Kobe University
2 Graduate School of Biostudies, Kyoto University
3 Graduate School of Science and Engineering, Ehime University
掲載誌
New Phytologist
報道問い合わせ先
- 神戸大学総務部広報課
E-Mail:ppr-kouhoushitsu[at]office.kobe-u.ac.jp(※ [at] を @ に変更してください)