千葉大学大学院理学研究院の高野和儀助教らの研究グループは、神戸大学バイオシグナル総合研究センターの伊藤俊樹教授、辻田和也准教授と共同で、がんの増殖に深く関わる「Ras-ERK経路」を抑える分子「DA-Raf」が、細胞膜注1)の脂質に結びつくことで、がんの原因となるシグナルを効率よく遮断する仕組みを世界で初めて明らかにしました。この発見は、がん治療薬の新しい開発ターゲットとなるだけでなく、細胞膜で起こるさまざまな生命現象を操作する技術革新にもつながる可能性があります。
本研究成果は、10月21日に国際学術誌 Life Science Alliance に掲載されました。
研究の背景
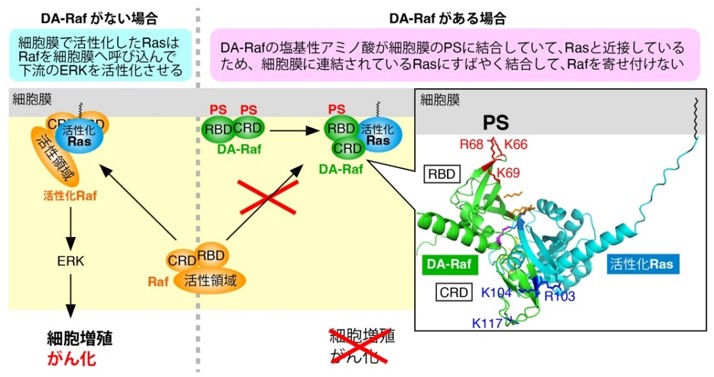
細胞が分裂して増える仕組みには、「Ras-ERK経路」と呼ばれる重要な経路があります。この経路では、細胞膜に結合しているRasという分子がスイッチの役割を果たし、活性化されたRasがRafという細胞の増殖を調節するタンパク質を細胞膜へ呼び寄せ、結合することでRafが働き始めます。活性化されたRafはさらに下流のERKへと至る分子を次々と活性化し、細胞増殖や分化といった生命活動に加え、がん細胞の増殖にも関与します(図1、破線より左)。
今回注目したDA-Rafは、Rafの一種であるA-Rafから生まれる「別の型(スプライシングアイソフォーム)」です。DA-RafはRasと結合する領域を持ちながらも、通常のRafが持つような酵素活性の領域を持たないため、Rasと結合してもスイッチを入れることができません。そのため、結果的にRas-ERK経路の働きを抑え、がんを抑制する“ブレーキ役”として働くことが知られていました参考文献1)。これまでDA-Rafは細胞内で非常に少ない量しか存在しないにもかかわらず、Ras-ERK経路を強力に抑えることがわかっていましたが、その理由は不明でした。そこで今回、研究グループはDA-Rafの分子構造と細胞内での分子の動きに着目して、この謎を解き明かすことを目指しました。
研究の成果
研究グループは、DA-Rafがどのようにして強力な“ブレーキ役”として働くのかを調べました。その結果、DA-Rafは細胞膜に含まれる脂質(ホスファチジルセリン (PS)注2))に結合することで、あらかじめ細胞膜に局在し、Rasに優先的に結びつくことがわかりました。これにより、がんの原因となるRas-ERK経路の働きを効果的に抑えていることを初めて解明しました(図1、破線より右)。
まず、細胞内での膜-タンパク質結合を詳しく解析したところ、DA-Rafの「Ras結合領域(RBD)」と「システイン注3)に富む領域(CRD)」の両方にある塩基性アミノ酸が協力して細胞膜と結合することがわかりました(図2、上段)。これによってDA-Rafは細胞膜上でRasの近くに配置され、結果的にRasとの結合力が高まりました(図2、下段)。例えるなら、磁石を近づけたときに吸い寄せられるように、結合の効率が増す仕組みです。
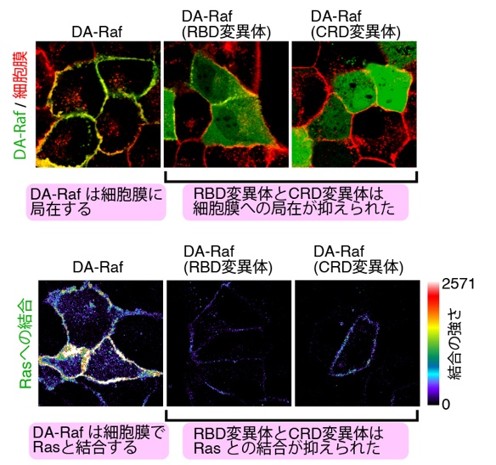
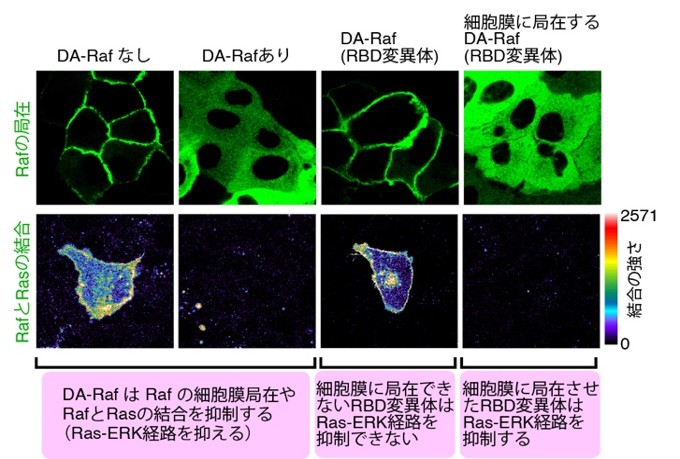
さらに、細胞膜に結合できないように改変したDA-Raf(DA-Raf(RBD変異体))では、Ras-ERK経路の抑制効果が失われることも確認されました(図3、左から1〜3列目までの比較)。逆に、細胞膜への結合を人工的に取り戻させると、再び強い抑制作用を示しました(図3、右列)。つまり、DA-Rafが細胞膜に結合することが、がん抑制機能の“決め手”であることが証明されたのです。これを椅子取りゲームに例えるなら、DA-Rafは予めRasの近くの椅子を占領することで、Rafが座る余地をなくしているのです。
今後の展望
今回の研究は、DA-Rafがどのようにしてがんを抑える力を発揮するのか、その仕組みを初めて解き明かしました。これまでDA-Rafの働きは「Rasと結合すること」のみによって説明されてきましたが、新たに「細胞膜への結合」が重要なプロセスであることが明らかになった点は大きな進展です。今回の研究で示されたDA-Rafの独自の働きは、Ras-ERK経路の異常が関与する、がんや筋萎縮症などの疾患の治療に向けた新しいアプローチとなる可能性があります。研究チームは今後、DA-Rafの細胞膜での動きや、他のRas関連因子との関係性をさらに詳しく調べることで、創薬への応用を目指します。
用語解説
注1)細胞膜
細胞の表面を覆う薄い膜。細胞の中と外を隔てるだけでなく、外からの刺激や情報を受け取り、細胞の反応をコントロールする役割も担っている。脂質が二重に並んだ「脂質二重膜」でできている。
注2)ホスファチジルセリン (PS)
細胞膜を構成する脂質のひとつ。通常は細胞膜の内側に多く存在し、細胞内のシグナルのやり取りに重要な役割を果たす。がんや細胞死などの場面でも注目される分子。
注3)システイン
アミノ酸の一種で、タンパク質中では分子間や分子内に「ジスルフィド結合」を形成し、立体構造を安定化させる。また、特有の化学的性質により、金属イオンや脂質と結合しやすい。Rafタンパク質のCRD(システインに富む領域)にも多数存在しており、この領域が細胞膜の脂質(例: ホスファチジルセリン)と結合する際に重要な役割を果たしている。
研究プロジェクトについて
この研究はJSPS科研費(JP15H04348, JP17K07328, JP21K06078)、千里ライフサイエンス振興財団、上原記念生命科学財団、内藤記念科学振興財団、持田記念医学薬学振興財団、武田科学振興財団、三菱財団、神戸大学バイオシグナル総合研究センター(282007, 201005)の助成を受けて実施されました。
論文情報
タイトル
DA-Raf synergistically binds to the plasma membrane and Ras to suppress ERK signaling.
DOI
10.26508/lsa.202503300
著者
Kazunori Takano*, Kazuya Tsujita, Akiko Suganami, Takuhiko Nakamura, Emiri Kanno, Yutaka Tamura, Toshiki Itoh, Takeshi Endo. *Corresponding author.
雑誌名
Life Science Alliance
参考文献1)
タイトル
DA-Raf, a dominant-negative antagonist of the Ras-ERK pathway, is a putative tumor suppressor.
DOI
10.1016/j.yexcr.2017.11.008
雑誌名
Experimental Cell Research