理化学研究所(理研)生命機能科学研究センター発生エピジェネティクス研究チームの高橋沙央里研究員、平谷伊智朗チームリーダー、染色体分配研究チームの北島智也チームリーダー、神戸大学大学院農学研究科の京極博久助教(理研生命機能科学研究センター染色体分配研究チーム客員研究員)、三重大学大学院生物資源学研究科の竹林慎一郎教授らの共同研究グループは、受精直後のマウス初期胚における特殊なゲノムDNA複製[1]様式を発見し、これが通常の体細胞型の複製様式に段階的に変化する過程で染色体分配異常[2]が高頻度に生じていることを見いだしました。
本研究成果は、体細胞で見られる安定したゲノムDNA複製が受精後に確立する仕組みや、哺乳類の発生初期に染色体分配異常が多い理由の理解につながり、受精卵を対象とした生殖医療においても基礎的知見となることが期待できます。
近年、体細胞におけるゲノムDNA複製の仕組みについての理解は進みましたが、哺乳類胚のゲノムDNA複製の解析は技術的に困難であり、初期発生過程で比較的多いとされる染色体分配異常の正確な頻度や原因は未解明でした。
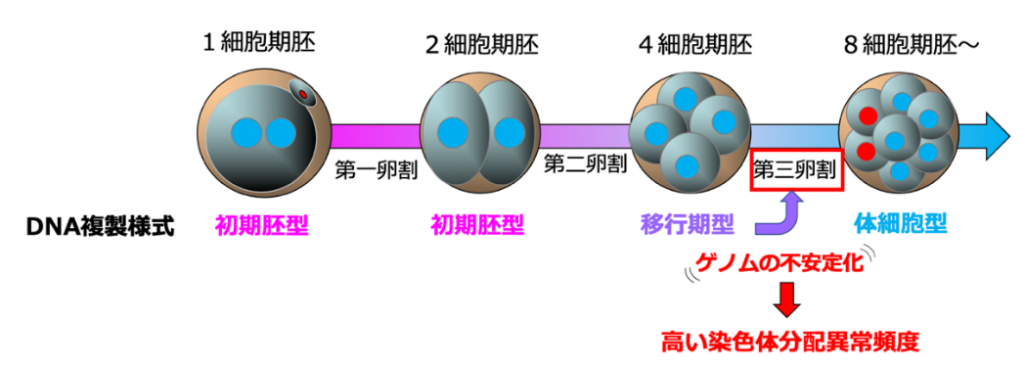
今回、共同研究グループは、独自の1細胞全ゲノム解析技術を駆使してマウス初期胚のDNA複製[1]を調べた結果、受精直後の1、2細胞期には体細胞のような複製タイミング[1]制御が見られず、DNA鎖の合成速度も体細胞に比べて格段に遅いことを発見しました。体細胞型のDNA複製様式は8細胞期になって初めて確立されますが、その中間の4細胞期は初期胚型と体細胞型の性質を併せ持つ「移行期型」の不安定な複製様式を示し、ここで生じた未複製DNA部位が染色体分配異常の引き金になっている可能性が高いことを明らかにしました。
本研究は、科学雑誌『Nature』オンライン版に掲載されました。
研究の背景
ヒトをはじめとする多細胞生物はたった一つの受精卵からスタートし、細胞分裂を繰り返しながら発生していきます。この間、生命の設計図であるゲノムDNA(染色体)は細胞分裂に先立って過不足なく複製され、二つの娘細胞に正確に分配されます。近年の研究により、体細胞におけるDNA複製の仕組みは解明が進んでいますが、胚発生初期にDNA複製がどのように制御されているかは未解明でした。また、哺乳類の初期発生過程において、染色体分配異常の頻度が体細胞に比べて高いことが知られていました。染色体分配異常は不妊や先天性遺伝子疾患の主要な原因と考えられていますが、なぜ初期胚において染色体の不均等分配の頻度が高いのかは長い間不明であり、その正確な頻度や原因も解明されていませんでした。その理由は、初期胚を1細胞レベルで解析する方法が存在しなかったためでしたが、共同研究グループは、2019年にこの限界を突破する1細胞全ゲノムDNA複製解析法、scRepli-seq法[3]の開発に成功しました注1)。
そこで共同研究グループは、この技術を用いてマウス胚発生初期のゲノムDNA複製の解析に着手しました。scRepli-seq法はその名のごとくDNA複製の解析法ですが、染色体異常の検出にも威力を発揮します。この利点を生かし、scRepli-seq法およびライブセルイメージング技術を用いて、発生初期における染色体分配異常の実態も詳しく調べることにしました。
注1)2019年2月26日プレスリリース「ゲノムDNA複製の真の姿を捉えた」
研究手法と成果
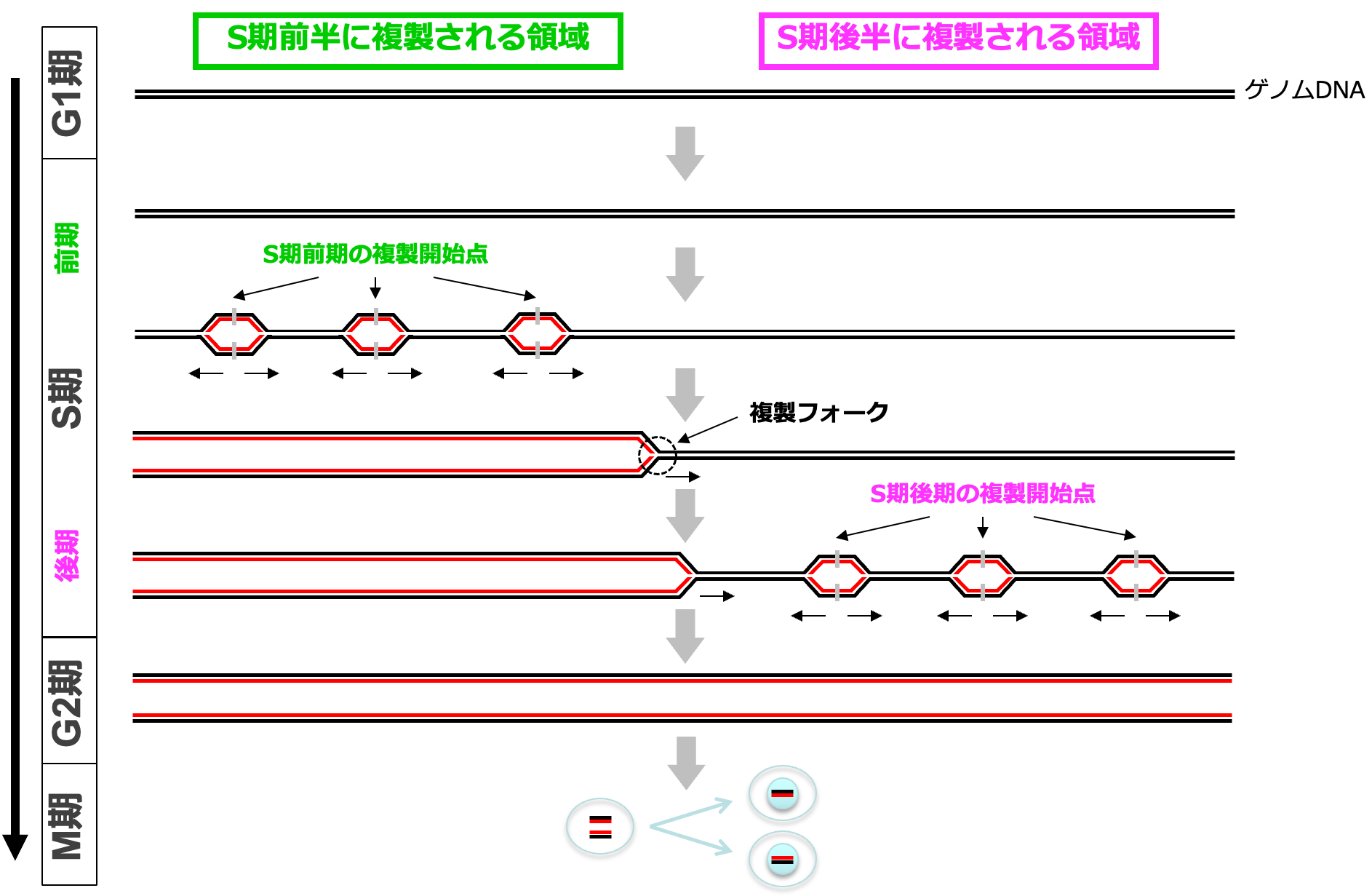
一般的に、体細胞のDNA複製では、ゲノムDNA上のどの領域がいつ複製されるか(複製タイミング)が厳密に制御されており、先(細胞周期[4]のS期[4]前半)に複製される領域と、後(S期後半)に複製される領域が明確に分かれて複製が順序よく進行します(図1)。
しかし、受精直後の1細胞期から胚盤胞(はいばんほう)期(3.5日胚)までのマウス初期胚をscRepli-seq法で調べたところ、驚くべきことに1、2細胞期には体細胞で見られるような複製タイミング制御が全く見られませんでした(図2)。すなわち、ゲノムDNA複製に順序が存在せず、S期を通してゲノムDNA上のあちこちから一様に複製が進行していることが分かりました。この一様な複製は、過去に報告のない初期胚特有の現象で、体細胞で見られる複製タイミング制御とは大きく異なります。しかし、4細胞期になると突如として体細胞型の複製タイミング制御が現れ、以後は体細胞型の複製タイミング制御が維持されていました。
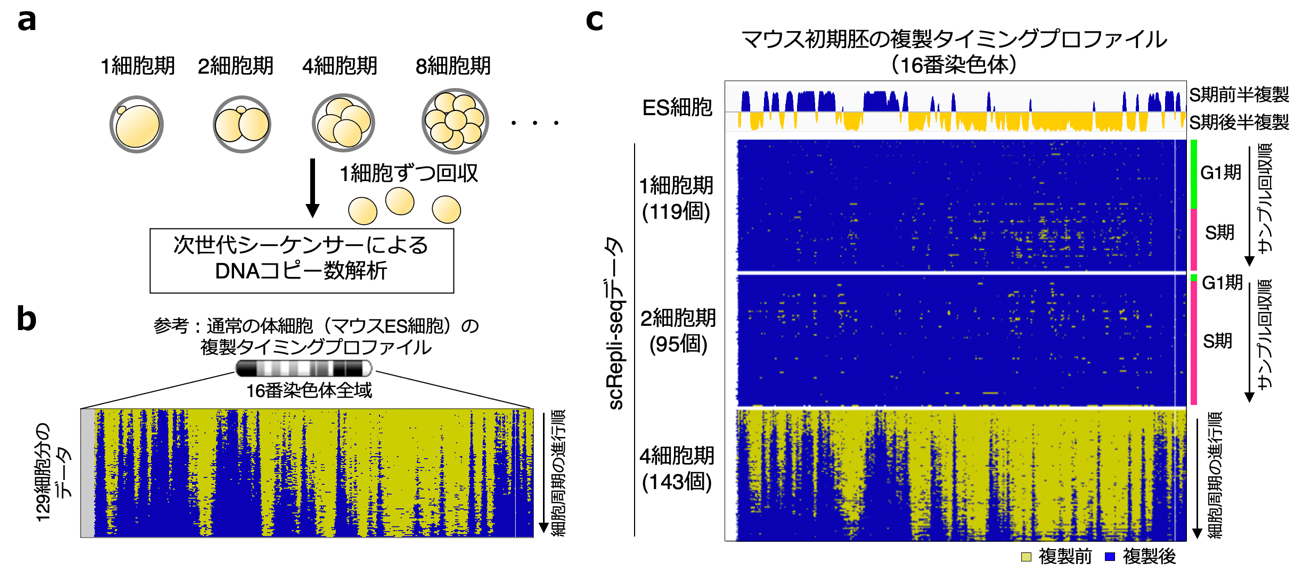
図2 マウスの初期胚発生に伴うDNA複製タイミングの変化
a)マウス初期胚発生ステージの模式図。発生ステージごとに胚を1個ずつの細胞に分けてから回収し、scRepli-seq法によってDNAコピー数解析を行った。今回のscRepli-seq法では、染色体を約80kb(8万塩基)ごとに区分けし、それぞれの区画に対応するリード(次世代シーケンサーで読み取られた短いゲノムDNA配列)が何個あるかを数えて、複製タイミングを調べた(複製終了後の区画のリード数は、複製終了前の区画のリード数の2倍になる)。
b)体細胞の典型的な複製タイミングの例として、マウスES細胞のDNA複製タイミングプロファイルを示す。S期全域から回収した129個のES細胞のscRepli-seqデータ(16番染色体;約9,800万塩基対)を、細胞周期(S期)の進行順に上から下に並べたもの。細胞周期の進行に伴い、染色体上の複製された領域(青色)が徐々に広がっていく様子が分かる(逆に、黄色の未複製領域は徐々に減っていく)。増殖中の培養細胞や体細胞では、このような複製タイミングプロファイルが観察できる。
c)マウス1、2、4細胞期胚における16番染色体のDNA複製タイミングプロファイル。4細胞期胚ではES細胞のような複製タイミングプロファイルが観察されたが、1、2細胞期胚ではDNAを合成中のS期細胞を解析しているにもかかわらずプロファイル全体がほぼ青色になり、この時期には複製タイミング制御が存在しないことが分かった。なお、この解析結果において、S期を通して染色体全体が青色になるのは全ての領域が瞬く間に複製を終えるということではなく、今回のscRepli-seq法では複製前と複製後のコピー数の差が次世代シーケンサーのリードからはまとまった領域として検出できない、つまり染色体上でDNA複製が徐々にかつ一様に進行することを意味している。
通常、体細胞のDNA複製においては、ゲノムDNAは約100万塩基対を一つのまとまりとして複製され、その中に複製開始点[5]は約10万塩基対に一つ存在します。それぞれの複製開始点からは1分間に約1,000~2,000塩基対の速さ(これを複製フォーク[6]速度と呼ぶ)でDNA鎖が両方向に合成され(図1)、約100万塩基対の領域を複製するには1時間程度かかります。ただし、複製タイミングの違いにより、これらの領域が全て同時に複製されるのではないため(図1)、S期全体の長さは8~10時間となっています。
一方、明瞭な複製タイミング制御が存在せず、ゲノム全体が一様に複製される1、2細胞期では、全ての複製開始点からのDNA合成がほぼ同時に起きるとすると数十分程度で全ゲノムの複製が完了する計算になります。しかし実際に1細胞期と2細胞期のS期の長さを調べたところ、4~5時間程度であることが分かりました。このことから、scRepli-seq法の解像度も考慮すると、1、2細胞期胚の複製開始点は体細胞よりも密に存在する一方、複製フォーク速度[6]は非常に遅いのではないかと予想しました。
そこで、DNAファイバー法[7]と呼ばれる方法で初期胚の複製開始点の分布と複製フォーク速度を調べたところ、1、2細胞期には、複製開始点は1.5~2万塩基対に一つと通常の体細胞よりも5倍以上密に分布しており、複製フォーク速度も1分間に約30塩基対と一般的な体細胞の30倍以上遅いことが分かりました(図3)。一方、8細胞期になると、複製フォーク速度は1分間に約760塩基対であり体細胞並みに速くなりました。しかし予想外なことに、1、2細胞期と8細胞期の間の4細胞期には、体細胞様の複製タイミング制御が現れたにもかかわらず、複製フォーク速度は1、2細胞期と同様に遅いままでした(図2、3)。すなわち、4細胞期の複製は初期胚型と体細胞型の両方の性質を併せ持つ、いわば「移行期型」であることが分かりました。
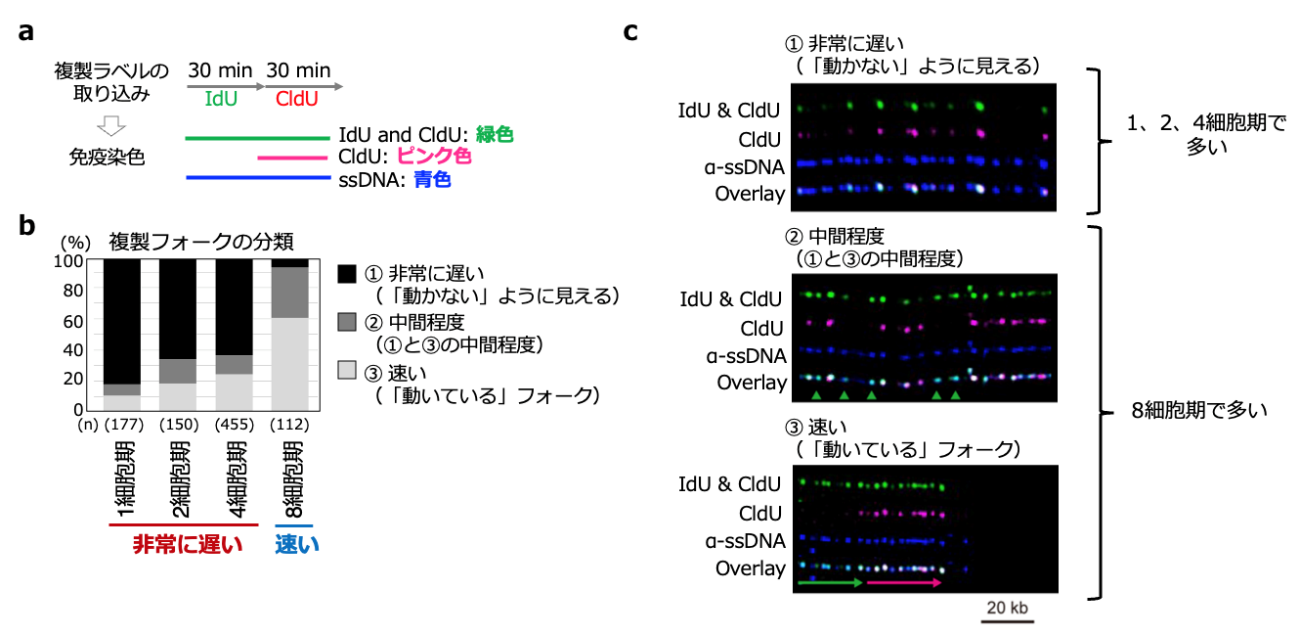
図3 マウスの初期胚発生に伴う複製フォーク速度の変化
a)DNAファイバー法による複製フォーク速度の測定方法の模式図。細胞に2種類の複製ラベル(IdU、CldU)を順に30分ずつ取り込ませ、スライドガラス上にDNAを伸展させ、免疫染色を行う。免疫染色には、IdUとCldUの両方を認識する抗体(緑色)とCldUのみを認識する抗体(ピンク色)を用い、さらに伸展させた1本1本のDNA分子を1本鎖DNA抗体(ssDNA:青色)により可視化した。
b)初期胚における複製フォークの分類をヒストグラムで示した。1、2、4細胞期胚では大部分が「動かない」ように見える非常に遅い複製フォーク(黒)であるが、8細胞期胚ではそれらが減少し、大部分が「動いている」速い複製フォーク(明るいグレー)になっていた。
c)複製フォーク分類の代表的な写真。IdUとCldUのいずれかを取り込んだDNAは緑色の蛍光を発し、そのうちCldUのみを取り込んだDNA(後半30分の複製ラベルに対応)がピンク色の輝点で識別できる。「動かない」ように見える複製フォークは、複製ラベルを取り込ませている前半30分と後半30分の時間帯において、複製フォーク速度が非常に遅く、緑色とピンク色、およびssDNAの青色の輝点が全てオーバーラップした白色の1点として検出される。一方で「動いている」複製フォークにおいては、前半30分の取り込みを示す緑色+青色のオーバーラップによるシアンの輝点(中央の写真の緑三角)と、後半30分の取り込みを示す白色の輝点の両方が観察される。下の写真では、シアンの輝点が左に、白色の輝点が右に見られることから、右方向に向かって複製フォークが進んでいることが分かる。なお、一般的な体細胞や培養細胞では大部分が「動いている」フォークである。
さらに共同研究グループは、体細胞に比べて頻度が高いとされる初期発生過程の染色体分配異常についても詳しく調べました。scRepli-seq法で染色体分配異常を検出した結果、4細胞期から8細胞期への分裂のときだけ染色体分配異常の頻度が約13%と、体細胞では考えられないような高い値を示しました(図4b)。さらに、染色体分配異常のタイプを調べたところ、ほとんどが染色体の切断による構造異常であることが分かり、実際にライブセルイメージングでも、染色体分配時に染色体が切断される瞬間を捉えることに成功しました(図4c)。
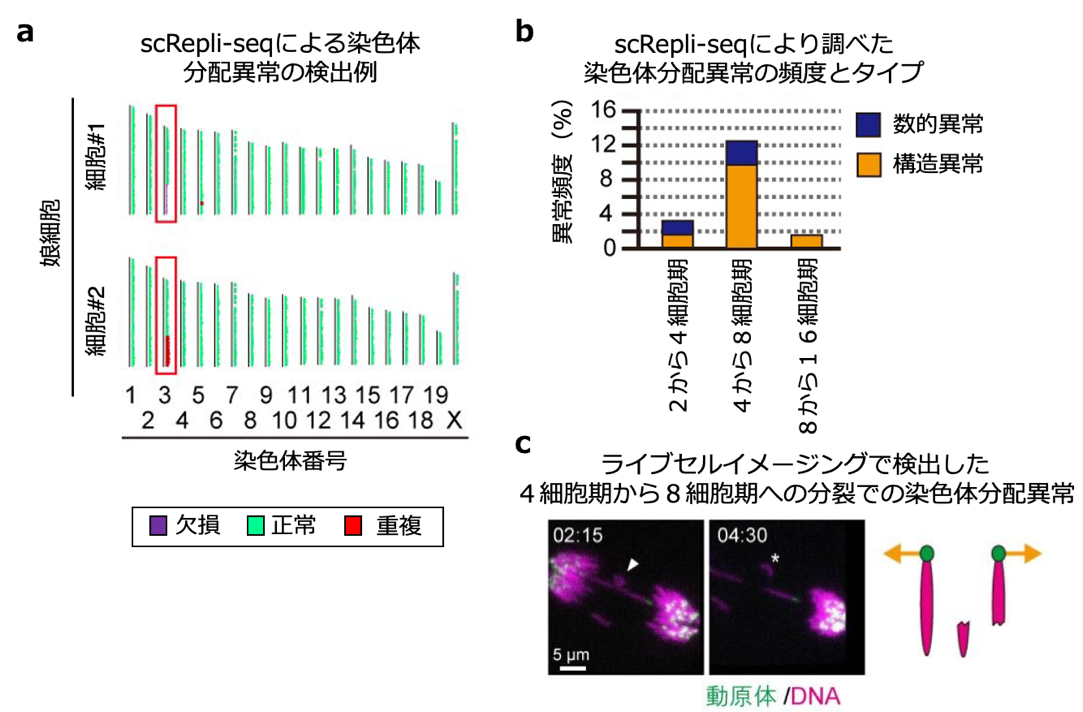
図4 マウスの初期胚の染色体分配異常
a)scRepli-seq法による染色体分配異常の検出例。DNAコピー数解析から染色体の部分的な欠損や重複を検出する。図は、3番染色体の同一領域に構造異常を持つ娘細胞のペア(#1=欠損、#2=重複)。
b)scRepli-seq法により検出した染色体分配異常の頻度とタイプ。4から8細胞期の分裂時に異常頻度が非常に高かった。
c)ライブセルイメージングによる染色体分配異常の検出例。染色体をマゼンタ(ヒストンタンパク質を染色)、動原体を緑(動原体近傍のDNAを染色)で標識した初期胚のライブイメージングにより、染色体が切断される瞬間を捉えることに成功した。ちぎれた染色体の断片を矢尻とアスタリスクで示す。
興味深いことに、切断された染色体DNA領域をscRepli-seq法で調べてみると、S期後半に複製される領域に集中していました(図5a、b)。さらに、分裂期の染色体DNA上の未複製領域を可視化する実験系[8]を構築して調べてみると、4細胞期には未複製領域のシグナルが多数観察されました(図5c)。以上の結果は、4細胞期から8細胞期への移行の際に、4細胞期胚の細胞がゲノムDNA複製を完了する前に分裂期に入ってしまい、未複製領域を残したまま染色体分配が行われることで分配異常が引き起こされることを示唆しています。
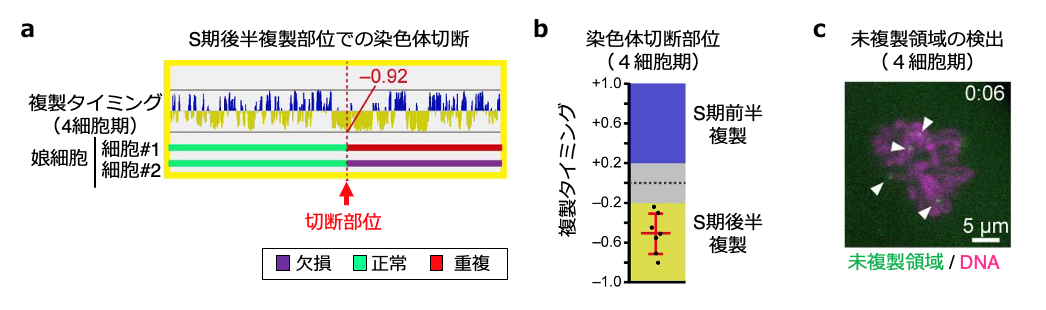
図5 染色体分配異常の原因の解明
a)染色体切断部位の同定方法。図は1番染色体のデータで、上の複製タイミングの図は横軸が染色体上の位置と長さに対応し、縦軸のピークは下側が複製タイミングの遅い領域(黄)、上側が複製タイミングの早い領域(青)を示している。下の図は、特定のDNAコピー数検出手法を用いて同定した切断部位(正常な染色体領域と、欠損もしくは重複の生じた領域の境目)を示す。
b)4細胞期における染色体切断部位の複製タイミング解析。染色体が切断される部位(黒点)は、S期後半に複製される領域に偏っていた。
c)分裂期におけるDNA上の未複製領域を可視化する実験系による4細胞期胚の観察。染色体中に多くの未複製領域の輝点(緑)が観察された。
こうなると、4細胞期の特殊な「移行期型」の複製様式とこの時期特有の染色体分配異常の関係が気になります。そこで、DNA複製が進行する様子をDNA複製マーカーであるPCNA-EGFP[9]を用いたライブセルイメージングによって観察しました。その結果、4細胞期胚は異常に長いS期を示し、染色体分配異常を起こした細胞ではS期がさらに有意に長くなっていました。また、DNAの材料となるヌクレオシド[10]の枯渇や、DNAの複製阻害・構造異常などを感知して活性化する「複製ストレス」のシグナルも4細胞期に有意に上昇していたことから、4細胞期胚は複製に長い時間が必要な複製ストレス下にあり、これが原因で染色体分配異常が起きている可能性が示唆されました。実際に、胚を培養する液の中にヌクレオシドを添加することでDNA複製フォーク速度を少し上げると、4細胞期から8細胞期への分裂時の染色体分配異常の頻度を下げることができました。このことから、4細胞期の特殊な移行期型DNA複製が、哺乳類の初期発生過程に顕著な染色体分配異常を引き起こしている要因であることが強く示唆されました。
以上の結果から、マウスの初期胚では、受精後数日の間は、ゲノム複製様式が目まぐるしく変化しながら複数の段階を経て体細胞型の複製様式が確立されていくことが初めて明らかになりました。その過程で、4細胞期胚は初期胚型と体細胞型の両方の性質を併せ持つ、いわば「移行期型」の複製様式を持つことが分かりました。そして、この特殊な「移行期型」複製が、4細胞期から8細胞期への分裂時の染色体分配異常の原因であることが示唆されました。
今後の期待
本研究は、マウス胚発生初期に、これまで誰も見たことがなかった「高密度の複製開始点」や「非常に遅い複製フォーク速度」といった特殊なDNA複製制御の仕組みがあることを明らかにしました。そして、体細胞型の複製様式が確立していく過程で、一時的にゲノムDNAが不安定化して「高頻度の染色体異常」が生じることも見いだしました。
DNAの二重らせん構造の発見に端を発するDNA複製研究の歴史は、真核生物では出芽酵母や哺乳類の培養細胞を中心に進んできましたが、今回の発見はこれらのモデルを使ったDNA複製研究分野の常識をことごとく覆すものです。初期胚で見いだされた特殊な複製様式の背後にはどのような仕組みが隠されているのでしょうか。一連の現象はヒトを含めた他の生物種でも進化的に保存されているのでしょうか。また、染色体異常を起こした細胞はその後どのような運命をたどるのでしょうか。今回の大きな発見の数々は、発生生物学・細胞生物学における複数の新たな研究課題の出発点であり、受精卵を対象とする生殖医療研究への展開も含め、今後への興味は尽きません。
補足説明
[1] ゲノムDNA複製、DNA複製、複製タイミング
DNA複製は、ゲノムDNA複製、ゲノム複製と同義。細胞分裂における核分裂の前に、DNAポリメラーゼという酵素によって、ゲノムDNAが過不足なく倍加される過程。なお、ゲノムDNAとは、生物の細胞が持っている全てのDNA配列情報のことを指し、真核生物の場合は核内にある染色体DNAを指すことが多い。複製タイミングとは、ゲノムDNA複製の時間的制御のこと。S期([4]を参照)において、各ゲノムDNA領域は、それぞれ特徴的な時期に複製されている。
[2] 染色体分配異常
マウスの細胞は19対(38本)の常染色体と1対(2本)の性染色体、合計40本の染色体を持つ。DNA複製が完了し、細胞分裂が行われる際には、この染色体1セットが過不足なく正しく娘細胞に分配される(染色体分配)。これが数的異常を持ったり、部分的に分配がうまくいかなかったりする場合、それらを染色体分配異常と呼ぶ。
[3] scRepli-seq法
増殖中の細胞でゲノムDNAが倍加していく過程を1細胞レベルで全ゲノム解析する方法。1細胞から抽出したゲノムDNAの全ゲノム増幅を行い、次世代シーケンサーを用いてこのゲノムDNAを解読し、ゲノムDNA上の複製前と複製後の領域をDNAコピー数によって識別する。scRepli-seqはsingle-cell DNA Replication sequencingの略。
[4] 細胞周期、S期
増殖中の真核細胞が繰り返す時間的なサイクル(期間)のことを細胞周期と呼ぶ。細胞周期の中で、分裂期(M期)は細胞分裂を行う期間、間期は分裂期以外の期間を指す。間期は、さらにG1期、S期、G2期に分けられる。S期は、DNA複製を行う期間である。
[5] 複製開始点
ゲノムDNA上で複製が開始される特定の領域のこと。複製起点ともいう。一般的にはDNA複製は複製開始点から両方向へ進行する。
[6] 複製フォーク、複製フォーク速度
複製フォークは、ゲノムDNA複製がまさに起こって2本鎖DNAが分離している部分のことを指す。1カ所の複製開始点から両方向に複製が起こる場合、複製フォークは2個である。また、ゲノムDNA複製に伴い複製フォークが動いていくときの速度を複製フォーク速度と呼ぶ。
[7] DNAファイバー法
スライドガラス上で複製フォーク速度や複製方向、複製開始点間の距離を測定する方法。複製ラベル(本研究ではチミジン塩基類似体のIdU、CldUを使用)を一定時間、細胞に取り込ませた後、細胞からゲノムDNAを抽出しスライドガラス上に伸展させる。伸展したDNA分子上で一定の時間内に取り込まれた複製ラベルの長さを測定し、塩基対に換算することで、複製フォーク速度を見積もることができる。
[8] DNA上の未複製領域を可視化する実験系
未複製領域を認識しDNA修復に重要な役割を持つタンパク質であるSLX4(Structure-Specific Endonuclease Subunit SLX4)にEGFP(Enhanced Green Fluorescent Protein)タンパク質を融合させることで、DNAの未複製領域を可視化する実験系。
[9] PCNA-EGFP
PCNA(Proliferating Cell Nuclear Antigen)とEGFP(Enhanced Green Fluorescent Protein)の融合タンパク質。PCNAはDNA複製が活発に行われている部分に局在するため、局在のパターンにより細胞周期の時期を可視化することが可能。
[10] ヌクレオシド
ヌクレオシド(Nucleoside)は、DNA複製においてヌクレオチド(Nucleotide)の前駆体として機能し、DNA合成の材料を供給する。DNA複製フォーク速度を上げることでも知られている。
共同研究グループ
理化学研究所 生命機能科学研究センター
発生エピジェネティクス研究チーム
チームリーダー 平谷伊智朗 (ヒラタニ・イチロウ)
研究員 高橋沙央里 (タカハシ・サオリ)
上級研究員 三浦 尚 (ミウラ・ヒサシ)
研究員 大字亜沙美 (オオジ・アサミ)
研究パートタイマーⅡ 近藤淑子 (コンドウ・ヨシコ)染色体分配研究チーム
チームリーダー 北島智也 (キタジマ・トモヤ)
(生命機能科学研究センター 副センター長)神戸大学 大学院農学研究科 生殖生物学研究室
助教 京極博久 (キョウゴク・ヒロヒサ)
(理研 生命機能科学研究センター 染色体分配研究チーム 客員研究員)
三重大学 大学院生物資源学研究科 分子細胞生物学研究室
教授 竹林慎一郎 (タケバヤシ・シンイチロウ)
大学院生(研究当時) 早川琢也 (ハヤカワ・タクヤ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、科学技術振興機構(JST)戦略的創造研究推進事業CRESTの研究領域「ゲノムスケールのDNA設計・合成による細胞制御技術の創出(研究総括:塩見春彦)」の研究課題「潜在的不安定性から読み解くゲノム設計原理(研究代表者:平谷伊智朗、JPMJCR20S5)」、同さきがけの研究領域「ゲノムスケールのDNA設計・合成による細胞制御技術の創出」の研究課題「顕微操作技術による初期胚の不安定なゲノムの分配システムの解明(研究代表者:京極博久、JPMJPR20K4)」、日本学術振興会(JSPS)科学研究費助成事業挑戦的研究(開拓)「1細胞全ゲノム解析の第二世代化と多次元化への挑戦(研究代表者:平谷伊智朗)」、同新学術領域研究(研究領域提案型)「細胞分化にともなうクロマチンポテンシャルの変化とその分子基盤(研究分担者:平谷伊智朗)」「染色体イメージングによる卵子インテグリティの予見(研究代表者:北島智也)」「受精卵が全能性を維持するために染色体分配異常から回復するメカニズムの解明(代表研究者:京極博久)」、同学術変革領域研究(A)「染色体が制御する生殖ライフスパン(研究代表者:北島智也)」、同基盤研究(B)「哺乳類卵母細胞における紡錘体二極化の機構の解明(研究代表者:北島智也)」、同若手研究「1細胞DNA複製タイミング解析による発生分化過程の核内コンパートメント動態予測(研究代表者:高橋沙央里)」、持田記念医学薬学振興財団「マウス初期胚発生における染色体三次元構造と遺伝子発現の統合1細胞解析(研究代表者:高橋沙央里)」、理研新領域開拓課題「TADからゲノム構築原理を読み解く(領域代表者:古関明彦)」「長時間分子生物学(領域代表者:北島智也)」による助成を受けて行われました。
論文情報
タイトル
"Embryonic genome instability upon DNA replication timing program emergence"
DOI
10.1038/s41586-024-07841-y
著者名
Saori Takahashi*, Hirohisa Kyogoku*+, Takuya Hayakawa, Hisashi Miura, Asami Oji, Yoshiko Kondo, Shin-ichiro Takebayashi, Tomoya S. Kitajima+, and Ichiro Hiratani+ (*共同筆頭著者、+共同責任著者)
掲載誌
Nature