細胞どうしが融合する現象(細胞融合※1)は、配偶子の授精、骨格筋の発生、胎児栄養膜の形成、破骨細胞※2による骨代謝、ウイルスの宿主細胞への感染など、ヒトの体内で起こる幅広い生理学的および病理学的プロセスにおいて見られる、基本的な生物学的現象です。神戸大学バイオシグナル総合研究センターのWan Yumeng大学院生、根本悠宇里助教、辻田和也准教授、伊藤俊樹教授のグループは、北海道大学大学院医学研究院の及川司講師、千葉大学大学院理学研究院の高野和儀助教、京都大学物質-細胞統合システム拠点の藤原敬宏特定准教授と共同で、細胞膜にかかる「張力」(細胞膜張力)※3が、細胞融合を制御する物理的な因子であることを世界で初めて明らかにしました。今後、破骨細胞の形成・機能異常による骨粗しょう症や、ウイルスの宿主細胞への融合を介した感染症に対する新しい治療戦略の開発につながる可能性があります。
この研究成果は、5月8日に国際学術誌『Journal of Cell Biology』に掲載されました。
ポイント
- 破骨細胞融合に細胞膜張力の低下が必要であることを発見した。
- 細胞膜張力の低下は浸潤性の細胞膜構造(インバドソーム※4)の形成を促進することを明らかにした。
- 今後、骨粗しょう症やウイルス感染症に対する新たな治療戦略につながる可能性がある。
研究の背景
細胞融合は、ヒトの体内で起こる幅広い生理学的および病理学的プロセスにおいて見られる、基本的な生物学的現象です。特に、マクロファージが骨髄由来単球から分化し、融合して破骨細胞に変化する過程は、骨代謝において中心的な役割を果たしています。一方で、体を構成するほとんどの細胞が無秩序に融合することはないことから、細胞融合は高度に制御された現象であると考えられますが、その詳しいメカニズムは明らかになっていません。破骨細胞融合において、がん細胞の浸潤性運動にもかかわる細胞膜の突出構造であるインバドソームの関与が知られています。インバドソームのように、アクチン細胞骨格により駆動される細胞膜の突出構造が形成・伸長するためには、細胞膜の物理的な剛性を克服する必要があります。したがって、細胞融合の分子メカニズムを解明するには、細胞膜の力学を理解することが不可欠でした。
研究の内容
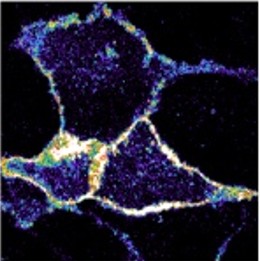
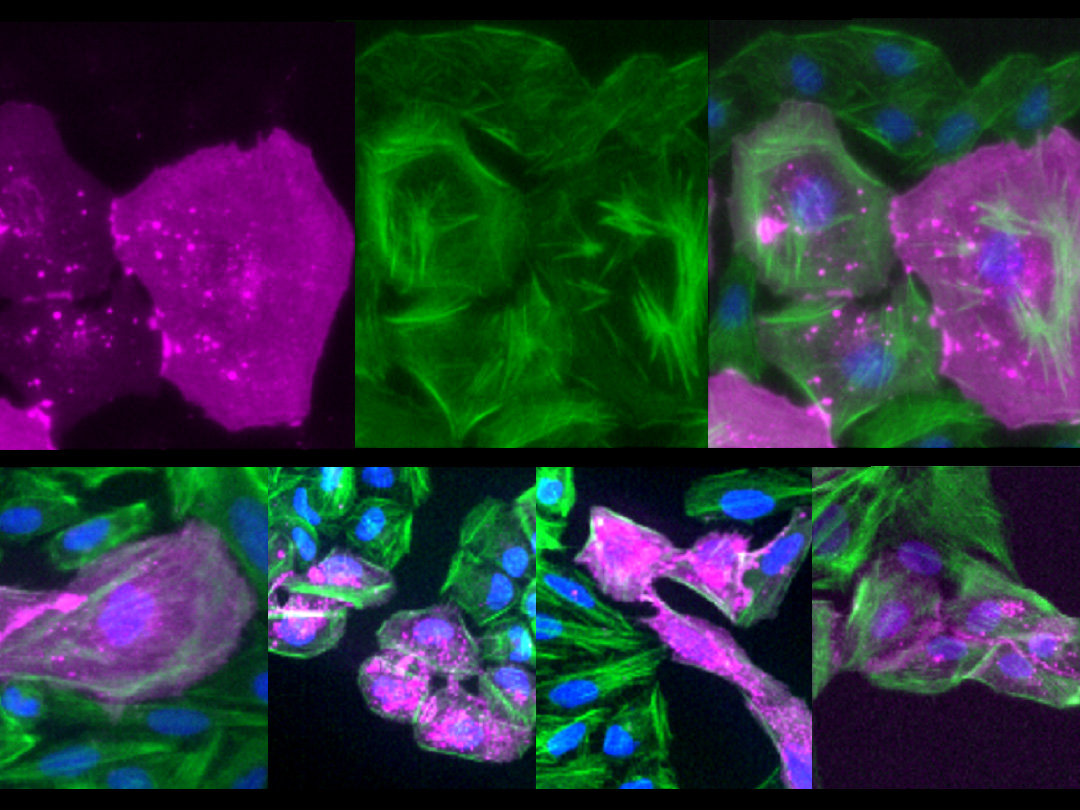
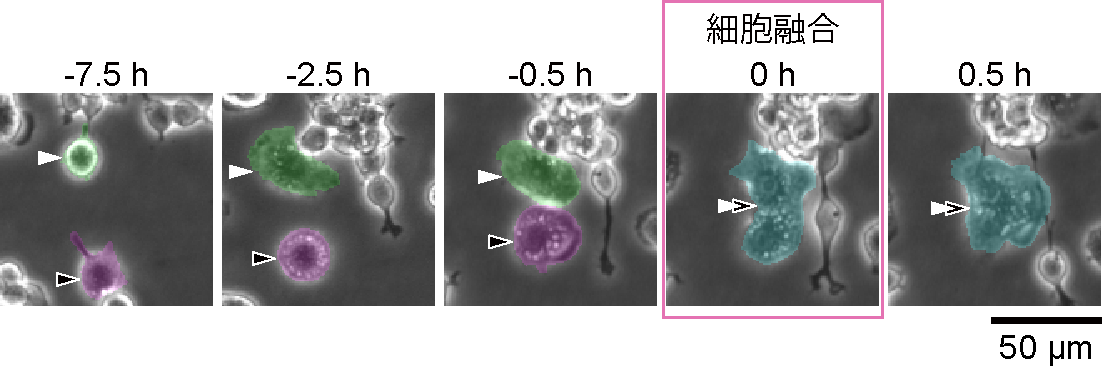
今回、研究グループは、破骨細胞融合(図1)をモデルとした細胞膜張力の計測と、人工遺伝子による膜張力の強化実験などを通じて、細胞膜にかかる「張力」が細胞融合を制御する物理的な因子であることを世界で初めて明らかにしました。
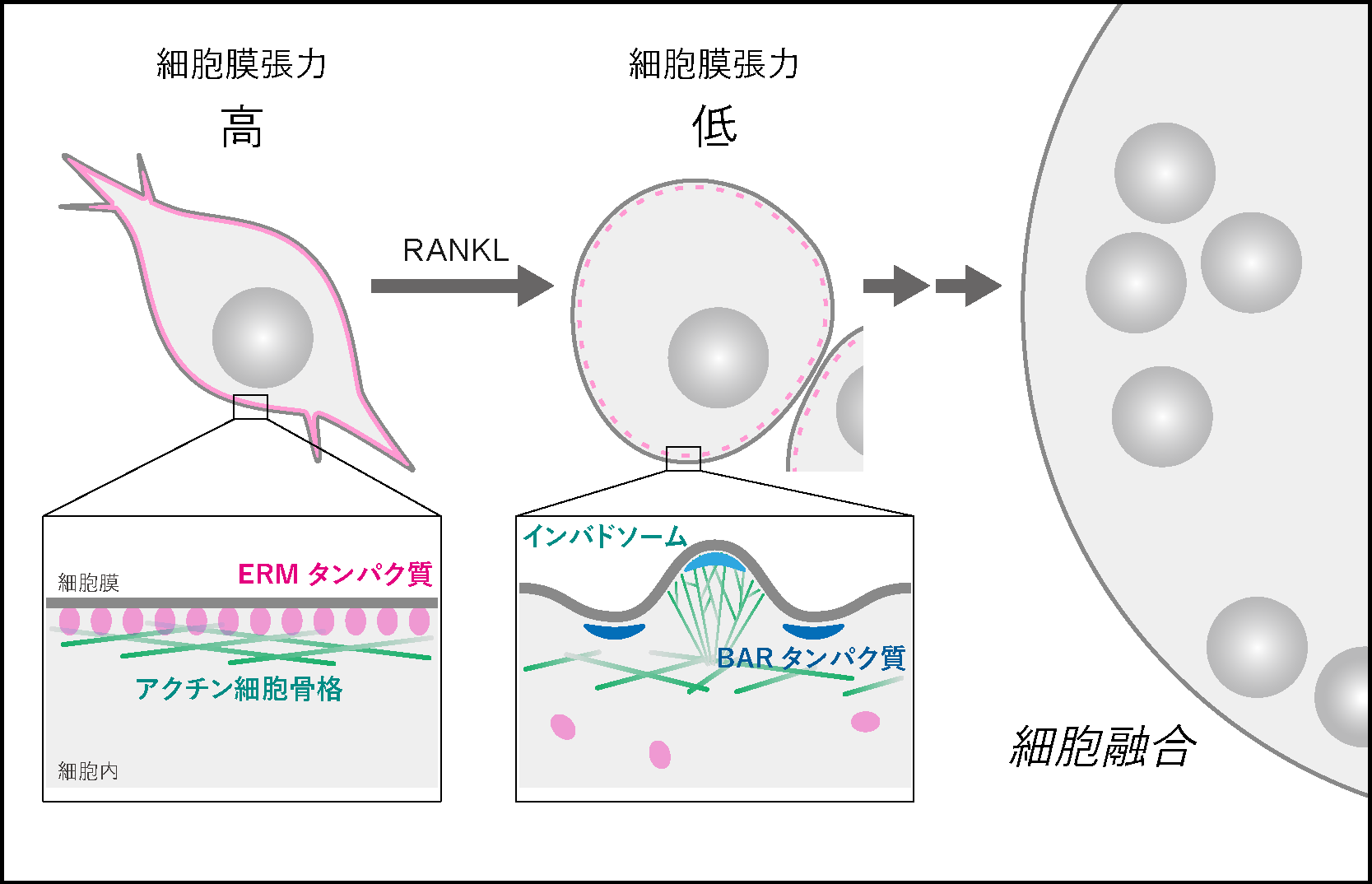
光ピンセット※5を用いて破骨前駆細胞の細胞膜張力を測定すると、細胞融合の誘導条件下において有意に膜張力が低下していることが分かりました(図2)。この時、細胞膜と、これを裏打ちするアクチン細胞骨格皮層をつなぐERM(Ezrin-Radixin-Moesin)タンパク質※6の遺伝子発現の減弱を伴っていました。
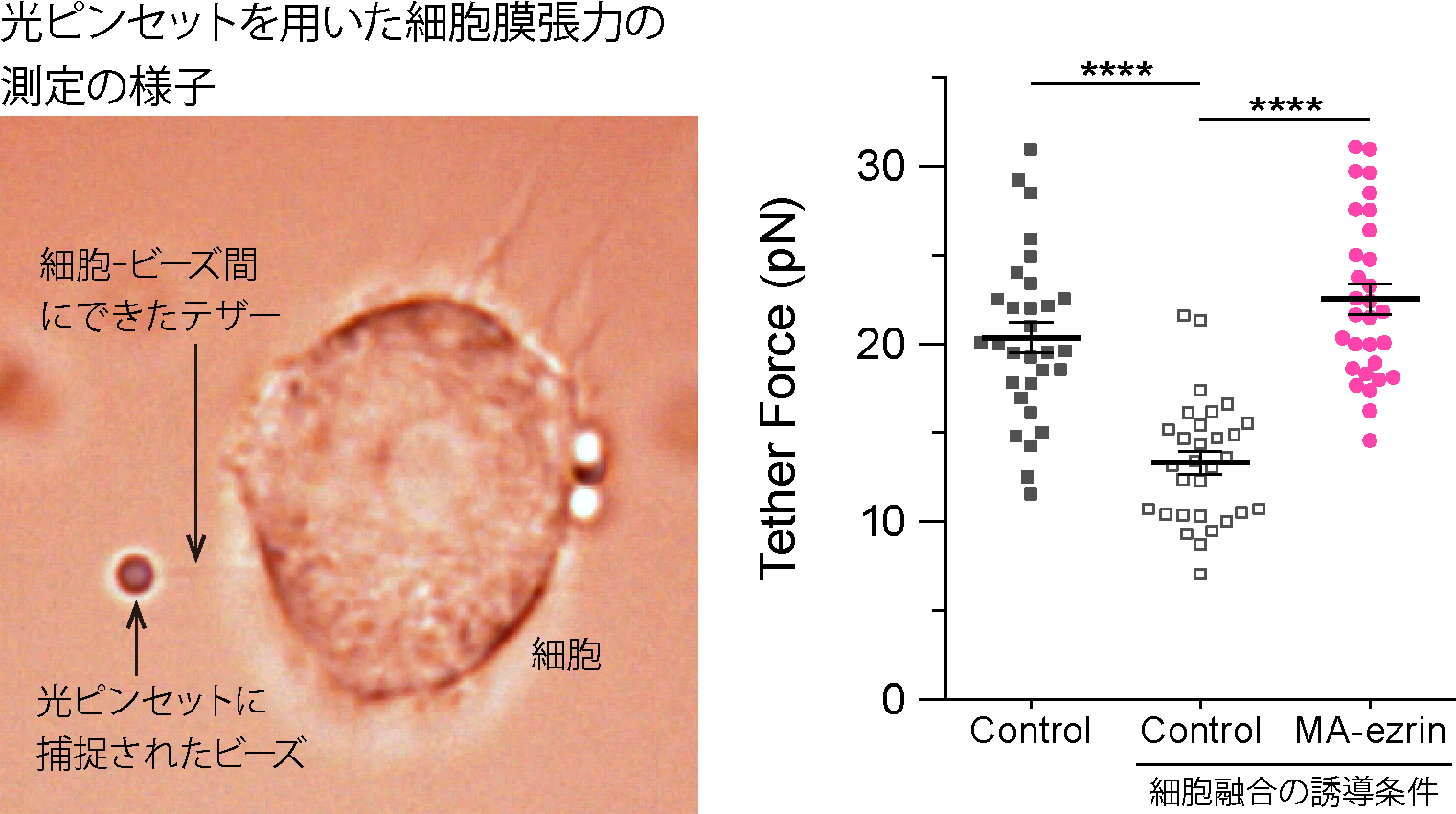
(右)細胞膜張力の測定結果。細胞融合を誘導すると、コントロール細胞(白)では膜張力が低下するが、恒常的に活性化したERMタンパク質を発現させた細胞(MA-ezrin、マゼンタ)では細胞膜張力は高いままであった。平均値±標準誤差。
そこで、恒常的に活性化したERMタンパク質を模した人工遺伝子を導入したところ、細胞融合条件下においても破骨細胞融合が顕著に抑制されることが観察されました(図3)。細胞膜張力の低下による細胞融合には、膜張力センサーとしての機能をもつ複数のBARドメインタンパク質※7が関与すること、これらのタンパク質が浸潤性のインバドソームと呼ばれる膜-アクチン細胞骨格構造の形成(図4)を通じて細胞融合を促進することなども明らかになりました。
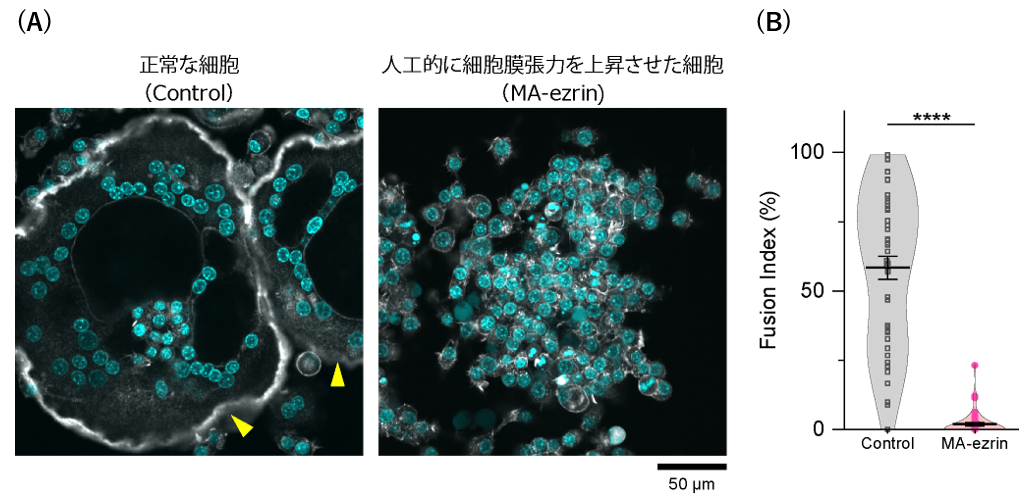
B:細胞融合能の定量結果。平均値±標準誤差。
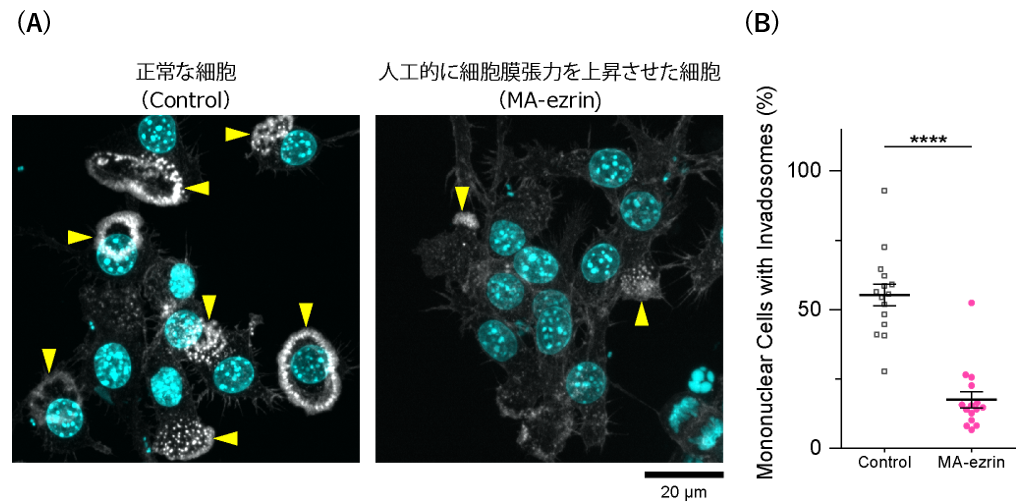
B:インバドソーム形成能の定量結果。平均値±標準誤差。
今後の展開
これらの発見により、細胞融合の機械的な制御因子としての細胞膜張力の役割が明らかになりました。本研究成果は、細胞の融合現象を制御する物理的な仕組みの一端を明らかにするだけでなく、破骨細胞の形成・機能異常による骨粗しょう症や、ウイルスの宿主細胞への融合を介した感染症に対する新しい治療戦略の開発につながる可能性があります。
用語解説
※1 細胞融合
同種、または異種の複数の細胞が融合し、単一の細胞膜中に複数の核、あるいは遺伝情報を持つ1つの細胞ができる現象。
※2 破骨細胞
古くなった骨や損傷した骨を分解、吸収する細胞。破骨細胞と、新しい骨を形成する骨芽細胞との適切なバランスにより健康な骨が維持される。骨吸収能を持つ成熟した破骨細胞になるには、細胞融合過程が必要である。
※3 細胞膜にかかる「張力」(細胞膜張力)
細胞膜の表面張力と、細胞膜-アクチン細胞骨格間の接着力により規定される細胞の力学的な性質。表面張力は細胞膜の伸展・退縮や細胞膜前後の浸透圧に、細胞膜-アクチン細胞骨格間の接着力はERMタンパク質などのリンカータンパク質に影響を受ける。
※4 インバドソーム(invadosome)
浸潤性がん細胞に見られるインバドポディア(invadopodia)と、破骨細胞やマクロファージなどの正常細胞に見られるポドソーム(podosome)を合わせた総称。ともにアクチン線維を中心とする核とそれを制御するタンパク質からなるドット状の構造で、細胞-細胞外基質間に形成され、細胞外基質との接着、分解のプラットフォームとして機能する。
※5 光ピンセット
レーザー光を集光させることにより、微小な物体を捕捉し動かす技術・装置。捕捉したシリカビーズを細胞膜に接触させて細胞膜上の糖タンパク質を結合させた後、ビーズを細胞から離していくと細い細胞膜のチューブからなるテザーが細胞-ビーズ間に形成される。本研究では、このビーズを直接「引っ張る」ことにより細胞膜張力を測定した。
※6 ERM(Ezrin-Radixin-Moesin)タンパク質
エズリン(Ezrin)、ラディキシン(Radixin)、モエシン(Moesin)という3種のタンパク質の総称。進化上高度に保存されたこれらのタンパク質は相同性が高く、細胞膜とその裏打ちのアクチン細胞骨格とを架橋し、細胞の形態や運動、接着など様々な機能を調節している。
※7 BARドメインタンパク質
脂質結合ドメインであるBAR(Bin-Amphiphysin-Rvs)ドメインを持つタンパク質群。BARドメインの二量体はバナナ型の構造を取り、湾曲した脂質二重層を感知、あるいは曲率を生成し膜を曲げる。
謝辞
本研究は、JSPS科研費(JP23K23838、JP23K27380、JP24K09447、JP21K06078、JP23K19352)、小野医学研究財団、三菱財団、ひょうご科学技術協会、SGH財団、バイオシグナル総合研究センターの助成を受けて実施されました。
論文情報
タイトル
“Mechanical control of osteoclast fusion by membrane-cortex attachment and BAR proteins”
DOI
10.1083/jcb.202411024
著者
Yumeng Wan1*, Yuri L. Nemoto1,2*, Tsukasa Oikawa3, Kazunori Takano4, Takahiro K. Fujiwara5, Kazuya Tsujita1,2†, and Toshiki Itoh1,2†
1. Division of Membrane Biology, Department of Biochemistry and Molecular Biology, Kobe University Graduate School of Medicine, Kobe, Hyogo 650-0017, Japan.
2. Biosignal Research Center, Kobe University, Kobe, Hyogo 657-8501, Japan.
3. Department of Molecular Biology, Graduate School of Medicine, Hokkaido University, Sapporo, Hokkaido 060-8638, Japan
4. Department of Biology, Graduate School of Science, Chiba University, Chiba 263-8522, Japan.
5. Institute for Integrated Cell-Material Sciences (WPI-iCeMS), Kyoto University, Kyoto 606-8501, Japan
掲載誌
Journal of Cell Biology