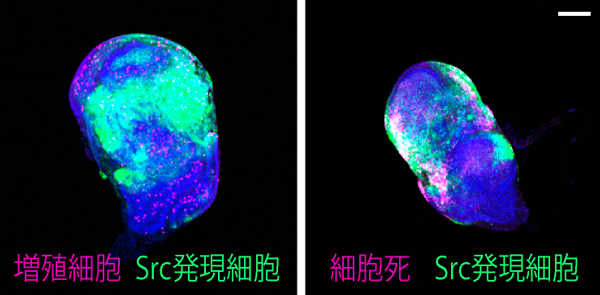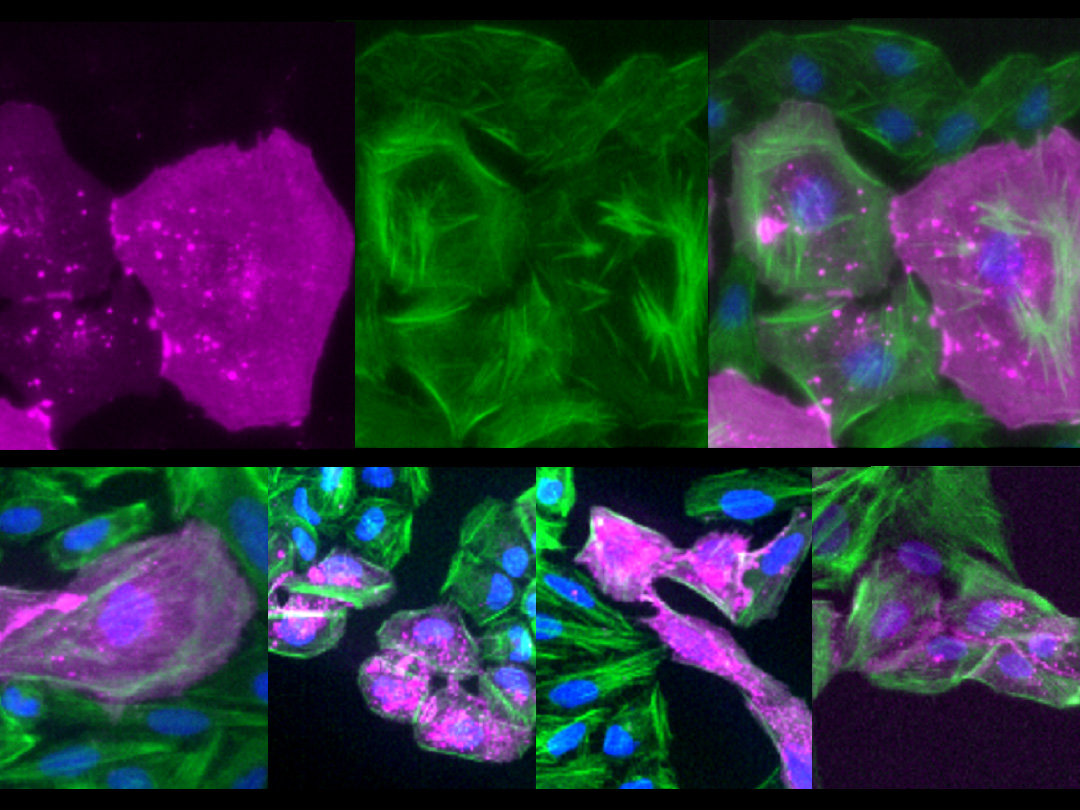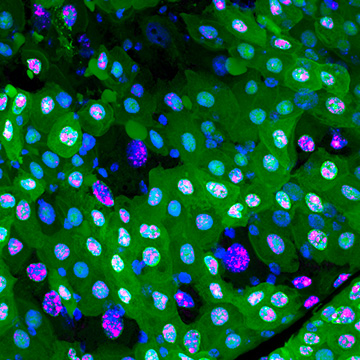
緑や赤の蛍光タンパク質がなくなった黒い細胞がエレボーシス (暗黒の細胞死) を起こしている
理化学研究所 (理研) 生命機能科学研究センター動的恒常性研究チームのユ・サガンチームリーダー (理研開拓研究本部Yoo生理遺伝学研究室主任研究員、神戸大学大学院医学研究科客員准教授)、開拓研究本部Yoo生理遺伝学研究室のハンナ・シエシエルスキー国際プログラム・アソシエイト (研究当時、現神戸大学大学院医学研究科博士課程学生) 、西田弘特別研究員 (研究当時、現ハーバード大学研究員)、生理学研究所の古瀬幹夫教授らの共同研究グループ※は、腸の細胞を新陳代謝させる分子機構として、これまでに知られていなかった新しいタイプの細胞死を発見しました。
本研究成果は、従来の細胞死の概念を更新すると同時に、腸の恒常性維持に関する従来の定説を覆す発見です。
さまざまな動物の腸では、細胞が日々入れ替わることで腸の恒常性が維持されています。腸細胞は従来、「アポトーシス (細胞の自殺) [1]」と呼ばれる細胞死の仕組みにより死んでいくと考えられてきました。
今回、共同研究グループはショウジョウバエ[2]を用いて、腸の細胞ではアポトーシスが起きるのではなく、これまで知られていなかったタイプの細胞死が腸細胞の入れ替わりを制御することを発見しました。この新しい細胞死は、その過程でさまざまなタンパク質が失われ、蛍光顕微鏡下では細胞が黒く見えることから、「エレボーシス (暗黒の細胞死)」と命名しました。
本研究は、オンライン科学雑誌『PLOS Biology』(4月25日付) に掲載されました。
背景
腸や皮膚などの新陳代謝の盛んな組織では、老化した細胞などは常に死にゆき、新しい細胞に置き換わります。このプロセスはターンオーバーと呼ばれ、さまざまな動物種において、組織の機能・形態の恒常性維持に重要な役割を果たしています。腸のターンオーバーでは、老化した細胞や障害を受けた細胞に「アポトーシス」と呼ばれるタイプの細胞死が起こり、アポトーシスを起こした細胞が腸の管腔側[3]に抜けていくことで、腸細胞が置き換わるというのが従来の定説でした。
共同研究グループは、実験・観察が容易なショウジョウバエの腸をモデルとして、本当にこの定説が正しいのか調べました。
研究手法と成果
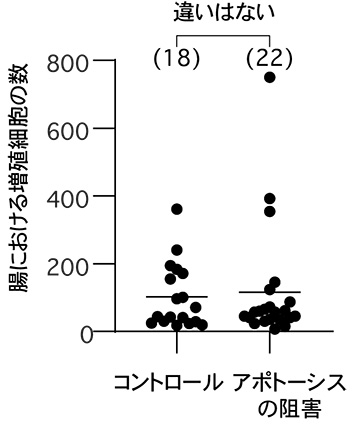
アポトーシスを阻害する操作を行った個体と正常個体 (コントロール) の腸を取り出し、増殖している細胞の数を計測したところ、統計的な差は見られなかった。腸の細胞増殖の程度は腸の組織恒常性を反映することから、アポトーシスの阻害は腸の恒常性に影響しないことが示された。かっこ内の数字は観察した個体数、グラフ上の横棒は平均値を示す。
共同研究グループはまず、腸細胞のターンオーバーを制御すると考えられてきたアポトーシスを止める操作を行い、それが腸の恒常性維持に影響するかどうかを調べました。その結果、定説とは異なり、アポトーシスを止めた場合でも、腸の恒常性維持には全く影響しないことが分かりました (図1)。
この結果を受けて、アポトーシス以外の原因で腸細胞が恒常的に死ぬ仕組みを探る過程で、Ance[4]というタンパク質が腸の管腔側の腸細胞の一部で発現することを偶然見いだしました (図2)。
このAnceを発現している細胞を調べると、Anceを発現していない、通常の腸細胞とは異なる特殊な性質を持つことが分かりました。Ance発現細胞の形態は非常に扁平であり、細胞機能にとって重要な核膜[5]やミトコンドリア[6]、細胞骨格[7]などを失っていました (図3)。
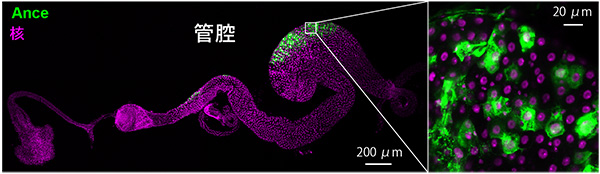
腸の一部の細胞は、Anceというタンパク質を発現する (緑)。マゼンタは細胞核を示す。
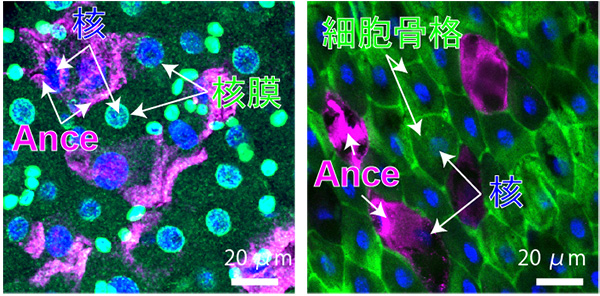
核膜もしくは細胞骨格と、核およびAnceを共染色した腸細胞の観察像。
左) 核膜 (緑)、核 (青)、Ance (マゼンタ) の共染色像。Anceを発現する細胞の核には、核膜が存在していないことが分かる。
右) 細胞骨格 (緑)、核 (青)、Ance (マゼンタ) の共染色像。Anceを発現する細胞の細胞質には、細胞骨格が存在していないことが分かる。
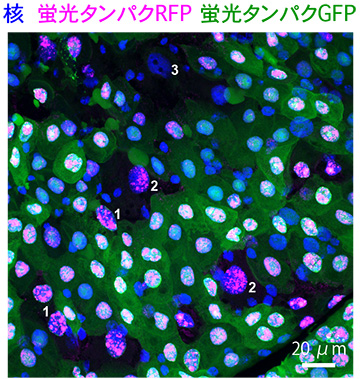
Ance発現細胞は、緑色蛍光タンパク質 (GFP、緑) および赤色蛍光タンパク質 (RFP、マゼンタ) といった人工的な蛍光タンパク質を失い、細胞質が黒く抜けている。これらの核を詳細に観察すると、1の細胞では核内にわずかなGFP (緑) の蛍光が見られるが、2の細胞では完全に消えている。3の細胞ではGFP (緑) もRFP (マゼンタ) も完全に見えなくなっており、核染色 (青) のみ確認できる。これらは、1、2、3の順に蛍光タンパク質の消失度合いが上がっていることを示す。
また、人工的に導入した蛍光タンパク質[8]を腸の細胞で強制的に発現させる実験を行ったところ、Ance発現細胞では、発現した蛍光タンパク質が段階的に失われていくことが分かりました (図4)。
最終的には、Ance発現細胞はDNAを失い、死にゆく細胞であることが分かりました。この細胞は多くのタンパク質を失い、顕微鏡下では真っ黒に見えることから、共同研究グループはこの新しい細胞死を「エレボーシス」と名付けました。「エレボス」は古代ギリシア語で「暗黒」を指す単語で、エレボーシスは「暗黒の細胞死」という意味になります。
これまでに知られている細胞死は、病理学的な特徴からアポトーシス、ネクローシス[9]、オートファジー[9]の大きく3種に分けられてきましたが、エレボーシスはこれら三つの細胞死のいずれの特徴も示しません。また、これらの細胞死が起こらなくなるような操作を行っても、エレボーシスを抑制することはできませんでした。
さらに、エレボーシスが起こっている細胞を詳細に調べたところ、その周りに腸幹細胞[10]が集まっていることが観察されました。これにより、エレボーシス細胞は腸幹細胞から分化した新しい腸細胞に置き換えられ、腸のターンオーバーが成立していることが分かりました。以上の結果から、ショウジョウバエの腸の恒常性維持は、従来考えられていたアポトーシスではなく、新しい細胞死であるエレボーシスによって制御されていることが明らかになりました (図5)。
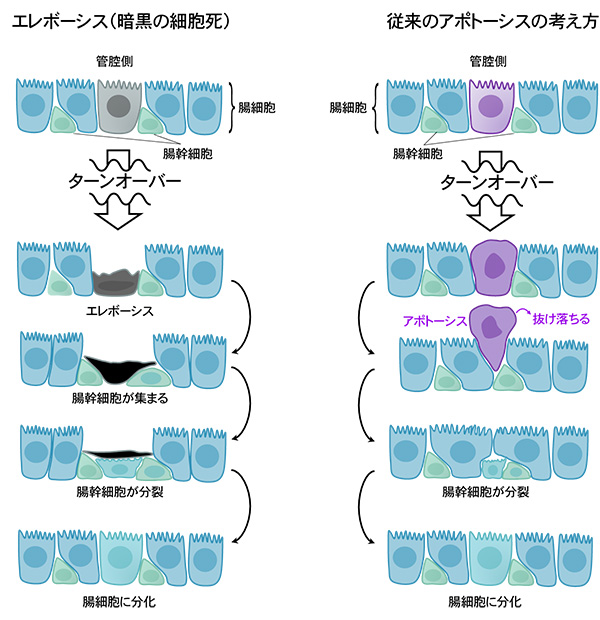
従来、腸の細胞はアポトーシス (細胞の自殺) により細胞死が起こり、アポトーシスの細胞が管腔側に抜けていくことでターンオーバーは起きると考えられていた (右)。今回の発見により、腸細胞の置き換わりの際に、細胞はエレボーシス (暗黒の細胞死) により死んでいくことが明らかになった (左)。
今後の期待
本研究成果には二つの大きな意義があります。一つは、腸の恒常性維持において、細胞の置き換わりの分子機構がアポトーシスによるものではないことが明らかになったことです。これは従来の定説を覆す発見です。アポトーシスの最中には、組織の中に隙間ができたり、炎症が起こったりするなど、常に組織の中で起こり続けるにはリスクがあることから、腸の組織のように常に細胞が入れ替わっている組織においては、アポトーシスは不適切な細胞死だと考えられます。
二つ目の意義は、新しい細胞死「エレボーシス」の発見です。エレボーシスはアポトーシスよりも静かな細胞死であり、多細胞生物の持つ基本的な仕組みの一つである細胞死という現象の枠組みが大きく変わる可能性があります。
共同研究グループは今後、エレボーシスがヒトの腸などでも存在するかの検証や、エレボーシスの詳細な分子機構の解明に取り組む予定です。
研究支援
本研究は、理化学研究所運営費交付金 (生命機能科学研究、開拓研究) で実施し、日本医療研究開発機構 (AMED) 革新的先端研究開発支援事業 (PRIME) 「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域における研究開発課題「老化の遺伝学的・非遺伝学的分子基盤の解明 (研究代表者:兪史幹) 」、日本学術振興会 (JSPS) 科学研究費補助金若手研究A「個体レベルでの物理的損傷に対する応答・修復メカニズムの解明 (研究代表者:兪史幹) 」、生理学研究所計画共同研究 (20-225、研究代表者:兪史幹、古瀬幹夫) 、群馬大学生体調節研究所共同研究 (21021、研究代表者:兪史幹、西村隆史) による支援を受けて行われました。
補足説明
- [1] アポトーシス (細胞の自殺)
- 多細胞生物を構成する細胞の死に方の一つで、プログラムされた細胞死とも呼ばれ、細胞の除去に重要な役割を果たす。シドニー・ブレナー博士らによるアポトーシスの研究に対して、2002年のノーベル生理学・医学賞が与えられている。アポトーシスの名は、「 (枯葉などが) 離れて落ちる」という意味のギリシャ語に由来する。
- [2] ショウジョウバエ
- ショウジョウバエは、体長2~3mm前後の大きさで、飼育が容易であり、遺伝学的な解析に優れている。さまざまな研究分野でモデル生物として用いられてきた。ショウジョウバエを用いた腸の研究は近年盛んに行われている。
- [3] 管腔側
- 腸など管状の臓器の細胞にとって、方向性として管腔側と基底膜側が存在する。腸の管腔側とは、腸の管の食べ物が存在する側である。
- [4] Ance
- アンギオテンシン変換酵素 (angiotensin converting enzyme) の略。Anceは、さまざまなタンパク質を分解する機能を持つ。
- [5] 核膜
- DNAが存在する核を取り囲む膜で、核の機能に重要な働きを持つ。
- [6] ミトコンドリア
- 酸素を使って細胞のエネルギーであるATPを産生する重要な細胞小器官。
- [7] 細胞骨格
- 細胞の形や運動機能に関わる、いわば細胞にとって「骨」のようなタンパク質。
- [8] 蛍光タンパク質
- クラゲやサンゴ由来の蛍光を発するタンパク質。下村脩博士らの蛍光タンパク質の発見に対して、2008年ノーベル化学賞が与えられている。
- [9] ネクローシス、オートファジー
- ネクローシスは細胞壊死とも呼ばれ、細胞に障害を与えると細胞死が起こる。オートファジーは細胞が自らの一部を分解する現象であり、本来、飢餓などのときに細胞が生存するための分子機構と考えられているが、オートファジーが進みすぎると細胞死に至る。大隈良典博士によるオートファジーの研究に対して、2016年ノーベル生理学・医学賞が与えられている。
- [10] 腸幹細胞
- 消化管の上皮は外界から取り込んだ物質に常にさらされ、皮膚と同様に細胞の脱落と再生により維持されている。腸幹細胞は、増殖能と、腸を構成する細胞に分化する能力を併せ持つ成体幹細胞である。ショウジョウバエ成虫の腸組織は安定な細胞で構成されると考えられていたが、近年、哺乳類と同様に幹細胞で維持されることが分かってきた。
※共同研究グループ
理化学研究所
生命機能科学研究センター 動的恒常性研究チーム
- チームリーダー ユ・サガン (Sa Kan Yoo)
(理研 開拓研究本部 Yoo生理遺伝学研究室 主任研究員、神戸大学大学院 医学研究科 客員准教授) - テクニカルスタッフⅠ 高野 智美 (たかの ともみ)
(理研 開拓研究本部 Yoo生理遺伝学研究室 特別技術員) - 大学院生リサーチ・アソシエイト 池川 優子 (いけがわ ゆうこ)
- 研究員 岡田 守弘 (おかだ もりひろ)
(理研 開拓研究本部 Yoo生理遺伝学研究室 研究員)
開拓研究本部 Yoo生理遺伝学研究室
- 国際プログラム・アソシエイト (研究当時) ハンナ・シエシエルスキー (Hanna
Ciesielski)
(現 神戸大学大学院医学研究科 博士課程学生) - 特別研究員 (研究当時) 西田 弘 (にしだ ひろし)
(現 ハーバード大学 研究員) - 研修生 (研究当時) 福原 彩 (ふくはら あや)
生理学研究所 細胞構造研究部門 古瀬研究室
- 教授 古瀬 幹夫 (ふるせ みきお)
- 助教 大谷 哲久 (おおたに てつひさ)
群馬大学 生体調節研究所 個体代謝生理学分野
- 教授 西村 隆史 (にしむら たかし)
論文情報
- タイトル
- “Erebosis, a new cell death mechanism during homeostatic turnover of gut enterocytes”
- DOI
- 10.1371/journal.pbio.3001586
- 著者
- Hanna M Ciesielski, Hiroshi Nishida, Tomomi Takano, Aya Fukuhara, Tetsuhisa Otani, Yuko Ikegawa, Morihiro Okada, Takashi Nishimura, Mikio Furuse, Sa Kan Yoo
- 掲載誌
- PLOS Biology