この度、東京大学医学部附属病院小児科 岡明教授、日本大学医学部小児科 森岡一朗教授、神戸大学医学部附属病院小児科 野津寛大特命教授らの研究グループは、神戸大学医学部附属病院臨床研究推進センターを治験事務局として、令和2年2月1日より、症候性先天性サイトメガロウイルス (CMV) ※1感染児を対象としたバルガンシクロビル塩酸塩ドライシロップの有効性および安全性を評価する多施設共同医師主導治験を開始しました。
先天性サイトメガロウイルス感染症について
先天性サイトメガロウイルス (CMV) 感染症は、CMVの母子感染※2によって、聴覚障害、発達遅延等の重い後遺症を残す可能性がある最も頻度の高い先天性感染症です。我が国の年間総出生児の0.3% (約2700人/90万人出生) が先天性CMV感染で出生しています。その感染児の約20%が、出生時に何らかの臨床症状を有して出生する症候性先天性CMV感染症です。この症候性先天性CMV感染症の約80%が、その後の乳幼児期に難聴や発達遅延を生じており、我が国の小児に大きな疾病負荷を与えています。
CMVに対する代表的な治療薬として、経口で投与可能なバルガンシクロビル※3が存在しますが、重い後遺症を残す可能性があるにもかかわらず、症候性先天性CMV感染症に対しては世界中で保険適用がありません。
バルガンシクロビルの有効性および安全性を評価する医師主導治験
抗CMV薬であるバルガンシクロビルを生後早期から投与することにより、聴力障害や発達遅延の治療、または症状進展を抑制しうることが、我が国や諸外国の臨床研究で示されています。我が国では、生後3週以内の新生児尿を用いた先天性CMV感染の診断が一般診療で可能となっていることから、本薬の保険承認下での使用が熱望されています。本治験では、後障害を引き起こす可能性の高い中枢神経障害を呈する症候性先天性CMV感染症を対象とし、バルガンシクロビル経口液剤 (バルガンシクロビル塩酸塩ドライシロップ) 治療の第III相多施設共同非盲検単群医師主導試験※4, ※5を行います。
治験の概要
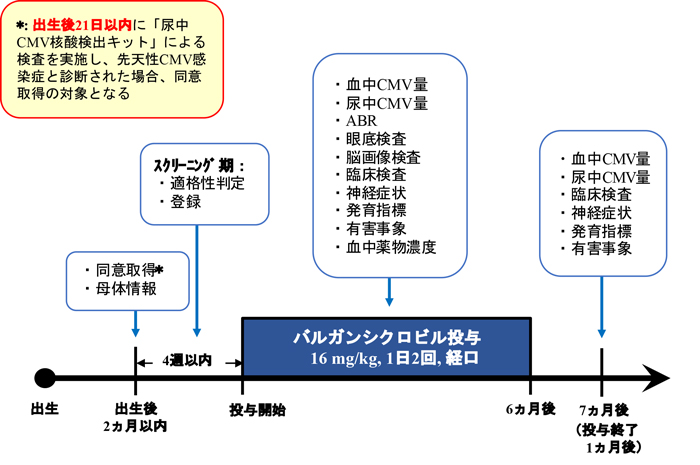
本治験は、選択基準 (表1) を満たす中枢神経障害を呈する症候性先天性CMV感染児を対象に、被験者の代諾者から文書により同意を取得した後に、バルガンシクロビル1回16 mg/kgを1日2回経口投与します。投与期間は6か月間とし、投与6か月後に定められた効果判定を行い、投与終了1ヵ月後まで観察・検査を行います (図1)。
治験の評価項目は以下のとおりです。
- a. 主要評価項目
- 治験薬投与6ヵ月時点の全血中CMV量のベースラインからの変化量
- b. 重要な副次評価項目
- 聴性脳幹反応検査に基づく聴力障害レベルのベースラインからの変化 (治験薬投与開始6ヵ月後)
- c. そのほかの副次評価項目
- 全血中CMV量の経時推移
- 治験薬投与6ヵ月時点の血漿中CMV量のベースラインからの変化量
- 尿中CMV量の経時推移
- ベースラインで認められた血小板数減少、肝機能障害、網膜脈絡膜炎の改善
- 発育に係る指標 (身長、体重、頭囲、寝返り、首すわり)
表1. 選択基準
- 生後21日以内に実施した尿中CMV核酸検出キットでCMV核酸が検出された先天性CMV感染症患者
- 以下のいずれかの中枢神経障害を呈する患者
① 小頭症
② 水頭症・脳室拡大
③ 脳室周辺石灰沈着
④ 大脳皮質形成不全・白質障害
⑤ 網膜脈絡膜炎
⑥ 聴性脳幹反応 (ABR) 異常 - 同意取得時、生後2ヵ月以内の患者
- 在胎期間32週以上で出生した患者
- 登録時体重1,800g以上の患者
- 本治験への登録前に治験の内容について十分な説明を行い、治験への参加に被験者の代諾者から文書による同意が得られた患者
研究支援
本治験は、日本医療研究開発機構 (AMED)「成育疾患克服等総合研究事業—BIRTHDAY」の支援を受けています。
用語の説明
- ※1 サイトメガロウイルス
- 正式名称はヒトヘルペスウイルス5 (HHV-5) で、様々な細胞・組織に感染することができる。一般に、健常な小児や成人は、CMVに感染しても症状を呈することは少ない。しかし、免疫抑制状態である移植を受けた患者や後天性免疫不全症候群 (エイズ) の患者、母子 (先天性) 感染では、重篤な病気を発症することが知られている。
- ※2 母子感染および母子感染症
- 細菌やウイルスなどの何らかの病原微生物がお母さんから赤ちゃんに感染することを「母子感染」という。サイトメガロウイルスは、赤ちゃんがお腹の中で感染する胎内感染を引き起こすことがある。母子感染の結果、病気を発症することを「母子感染症または先天性感染症」という。
- ※3 バルガンシクロビル
- バルガンシクロビルは、抗サイトメガロウイルス薬の1つ。ウイルスの複製を阻害することにより、抗ウイルス効果を発揮する。静脈内投与を必要とするガンシクロビルをL-バリンでエステル化したプロドラッグであり、経口投与ができる。小児用製剤であるバルガンシクロビルの経口液剤 (バルガンシクロビル塩酸塩ドライシロップ) が、2018年12月より我が国でも使用可能である。我が国の適応疾患は、後天性免疫不全症候群 (エイズ)・臓器移植 (造血幹細胞移植も含む)・悪性腫瘍におけるサイトメガロウイルス感染症と臓器移植 (造血幹細胞移植を除く) におけるサイトメガロウイルス感染症の発症抑制である。注意すべき副作用として、骨髄抑制 (特に好中球減少)、動物実験で催奇形性、精子形成の低下、発癌性がある。
- ※4 第III相多施設共同非盲検単群試験
- 多くの患児 (本治験では25人) について、「くすり」の有効性、安全性、使い方を最終的に確認する (第III相試験)。確認の方法は、一般にはプラセボ (偽薬) を用いて治療者や被験者ともにわからないようにして比較を行うが、本治験では実薬のみを用いて中身を明らかにした非盲検単群試験で行う。また、本治験は、1つの施設で行うものではなく、6施設 (東京大学病院、日本大学板橋病院、名古屋大学病院、藤田医科大学病院、神戸大学病院、長崎大学病院) で行う。
- ※5 医師主導治験
- 治験の準備から管理を医師自ら行うことを医師主導治験という。医師主導治験では、治療薬が必要とされているにも関わらず、採算性の問題等で製薬会社が治験を実施できない薬や既に承認されている薬の適応症を拡大することなどを目的に医師が自ら治験の計画を立てて治験を実施する。