神戸大学大学院科学技術イノベーション研究科の西田敬二特命准教授・近藤昭彦教授と、東京大学先端科学技術研究センターの谷内江望准教授、静岡県立大学食品栄養科学部環境生命科学科の原清敬准教授らの研究グループは、DNAを切らずに書き換える新たなゲノム編集技術「Target-AID」の開発に成功しました。
これまでのゲノム編集技術の課題を解決する手法であり、高度なゲノム編集操作を可能とし、有用生物の育種から疾患研究、創薬開発などを加速させる強力なツールを提供すると共に、将来的には新たな遺伝子治療手法としての応用も期待されます。
この研究成果は、8月5日 (日本時間) に「Science」にオンライン掲載されました。
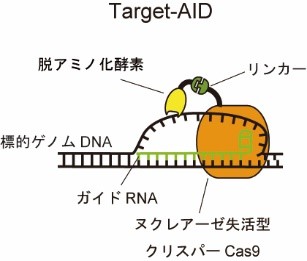
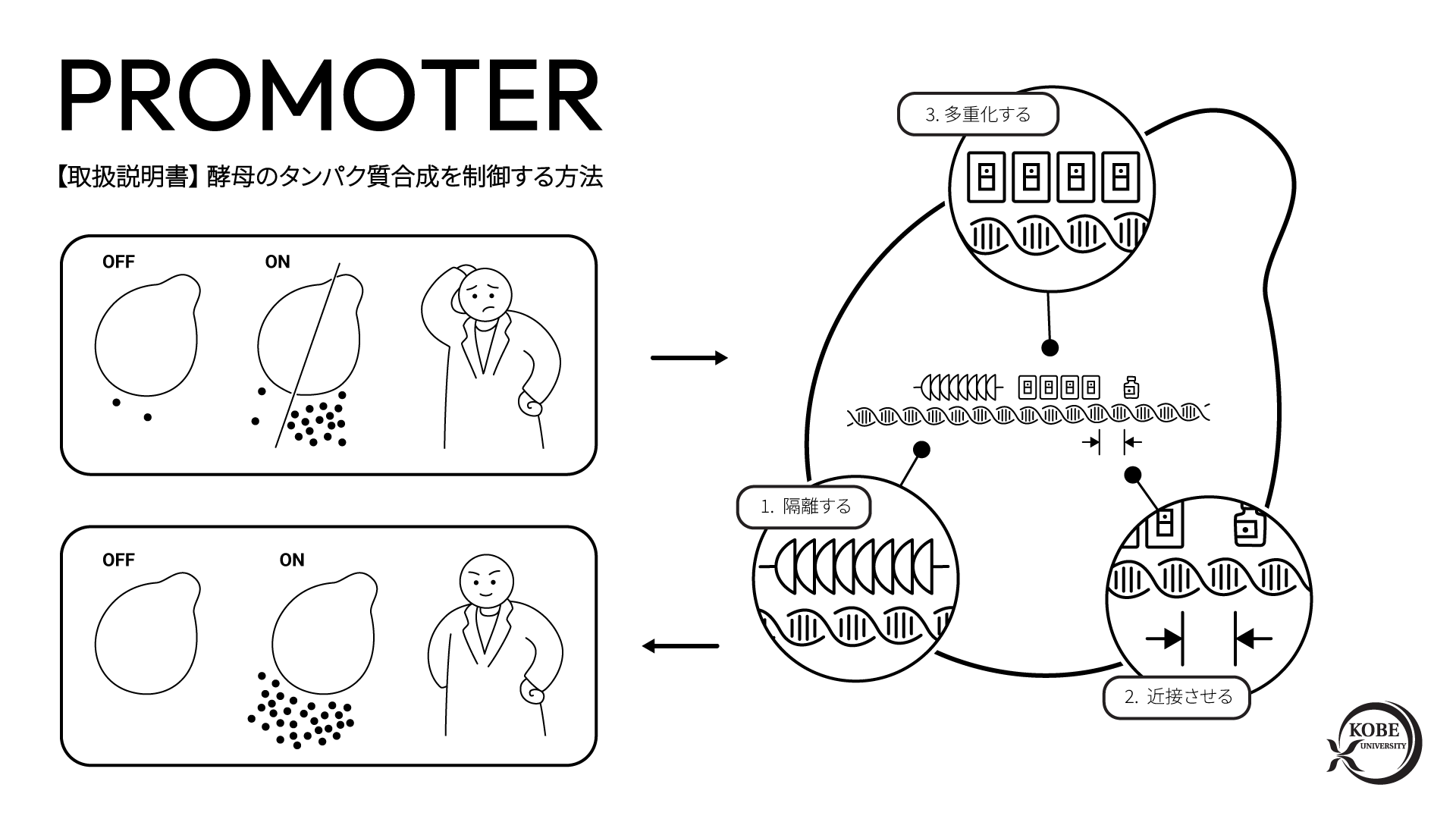
ヌクレアーゼ活性を失ったクリスパーCas9にリンカーを介して脱アミノ化酵素デアミナーゼを連結させている。ガイドRNAが標的のゲノムDNA配列を認識してDNAを一本鎖に解離させ、脱アミノ化酵素がその解離状態のDNA塩基を変換する。
様々な生物のゲノム情報を直接操作し、かつ人工的な配列を残さないゲノム編集技術は、近年著しい進歩を遂げており、生命科学全般から先進医療分野にまで至る革命的なツールとなりつつあります。
非常に有効な手法として知られている「人工ヌクレアーゼ※1」を利用したゲノム編集技術は、標的とする部位においてDNAを切断し、DNAが修復する際に、目的の遺伝子が改変されることを期待するものです。この手法は、遺伝子操作が困難であった生物材料においても非常に有効であることから、動物や植物などの高等真核生物を中心に導入が進んでいます。
一方で、切断されたDNAの修復過程で、意図した改変が起こるとは限らない不確実性や、染色体の切断による細胞毒性※2が大きな課題でした。
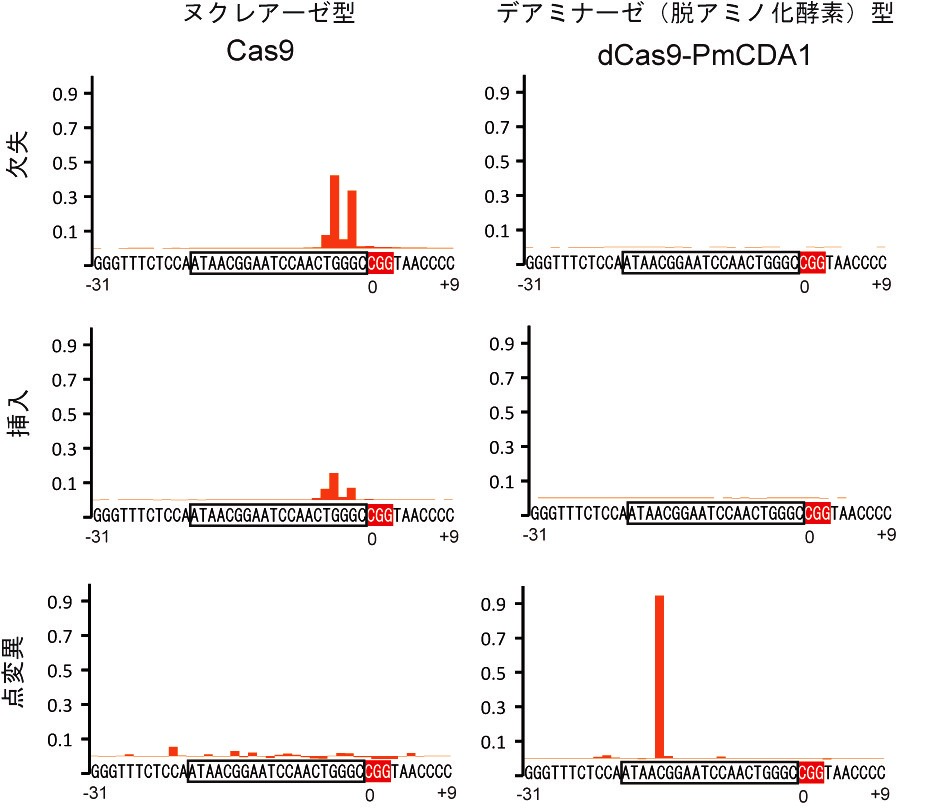
本研究では、人工ヌクレアーゼを利用した技術である「CRISPRシステム」から、ヌクレアーゼ活性を除去したものに、脱アミノ化酵素であるデアミナーゼを付加した人工酵素複合体 (図1) を構築し、酵母および動物細胞の中で発現させることで、狙った点変異※3を高効率に導入して遺伝子機能を改変できることを実証しました (図2)。また、DNAを切断せずに改変することで、従来のヌクレアーゼ型に比べて、細胞毒性が大幅に低減していることも確認できました。
本技術により、細胞に大きな負担をかけない形で、効率よく意図した改変を行えることから、より高度で多様なゲノム編集操作を実現することができます。有用生物の育種から疾患研究、創薬開発などを加速させる強力なツールとなり、将来的には、新たな遺伝子治療手法としての応用も期待されます。
標的DNA配列の前後含めて40塩基の範囲において実際に引き起こされた変異の頻度を解析している。
ヌクレアーゼ型 (左側) では挿入や欠失が中心であるのに対して、デアミナーゼ型 (右側) では限られた部位での点変異のみが起こる。
用語解説
※1: 人工ヌクレアーゼ
DNAの鎖の任意の配列を認識して切断するよう、人工的にデザインされた酵素。
※2: 細胞毒性
細胞に対して死や機能障害等の影響を与える性質。
※3: 点変異
DNAの一つの塩基が別の塩基に置き換わる突然変異。
研究助成
文部科学省「先端融合領域イノベーション創出拠点形成」プログラム「バイオプロダクション次世代農工連携拠点」、文部科学省 科学研究費補助金、経済産業省 革新的バイオマテリアル実現のための高機能化ゲノムデザイン技術開発、内閣府 総合科学技術・イノベーション会議の戦略的イノベーション創造プログラム (SIP) 「次世代農林水産業創造技術」 (管理法人:農研機構)
掲載論文
タイトル
“Targeted nucleotide editing using hybrid prokaryotic and vertebrate adaptive immune systems”
著者
Keiji Nishida, Takayuki Arazoe, Nozomu Yachie, Satomi Banno , Mika Kakimoto , Mayura Tabata , Masao Mochizuki , Aya Miyabe , Michihiro Araki , Kiyotaka Y. Hara, Zenpei Shimatani and Akihiko Kondo
掲載誌