熊本大学大学院生命科学研究部 (薬学系)、遺伝子機能応用学研究室の甲斐広文教授らは、神戸大学大学院医学研究科内科系講座小児科との共同研究により、アルポート症候群の原因遺伝子4型コラーゲンの遺伝子型から、病気の重症度を予測するシステムの構築に成功しました。
遺伝性疾患「アルポート症候群」の患者は、原因タンパク質である4型コラーゲンの異常により、多くは小児期に慢性的な腎機能の低下が引き起こされ、腎不全へと移行することが余儀なくされることが明らかになっています。これまでに数百種類の4型コラーゲンの変異が報告されており、変異によって病態の重症度が異なることがわかっています。しかしながら、遺伝子変異の種類から、どの程度の重症度の腎症を認めるかを予測することは困難でした。今回、甲斐教授らは、神戸大学大学院医学研究科内科系講座小児科が有するアルポート症候群患者の腎症の重症度と遺伝情報に関する膨大なデータと、Split NanoLuciferase (split NanoLuc🄬) による細胞ベースの4型コラーゲン三量体評価系を組み合わせることで、4型コラーゲンの遺伝子型から、病気の重症度を予測することが可能であることを証明しました。今後、アルポート症候群患者の遺伝子の変異情報のみで、重症度を予測するシステムの構築へと繋がれば、遺伝性疾患のプレシジョン・メディシン (精密医療、遺伝子型に応じた治療方針を模索する) の分野を大きく推進することに貢献できます。
本研究の成果は、「Kidney International Reports」のArticle in pressに令和2年1月30日に公開されました。
ポイント
- アルポート症候群患者の遺伝子変異情報と、4型コラーゲン三量体評価系を組み合わせることで、4型コラーゲンの遺伝子型から、アルポート症候群における腎症の重症度を予測することが可能であることを証明しました。
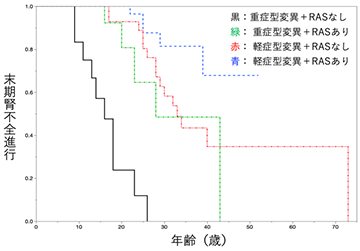
- 上記の評価系を用いて評価を行った結果、重症の腎症を認める変異は4型コラーゲンの細胞内形成三量体または細胞外分泌三量体が著しく低下したのに対し、軽症の腎症を認める変異は細胞外分泌三量体のわずかな低下に留まることがわかりました。
- 今回の発見により、4型コラーゲンの遺伝子変異情報のみで、腎症の重症度を予測できるようになり、アルポート症候群のみならず遺伝性難病のプレシジョン・メディシン (精密医療、遺伝子型に応じて治療を決定する医療) の推進に貢献することが期待できます。
研究の背景
近年のゲノム解析技術のめざましい進歩により、疾患関連遺伝子の網羅的解析が可能となり、遺伝子情報に基づいたプレシジョン・メディシンの機運は様々な疾患で高まっています。遺伝性腎疾患の分野においても、大規模な遺伝子解析が普及し、原因遺伝子変異の同定による正確な診断と新たな疾患分類が精力的に行われています。アルポート症候群は、遺伝性の腎臓疾患の一つで、腎臓における尿の濾過機構を担う糸球体に存在する基底膜の構成因子である4型コラーゲンの異常により、糸球体濾過機能の異常と、それに伴う慢性的な腎臓の機能の低下を引き起こします。最終的には人工透析もしくは腎移植なしでは末期腎不全に陥り死に至る重篤な疾患で、我が国でも難病に指定されています。
アルポート症候群の原因遺伝子である4型コラーゲンは、α3、α4、α5の3本のポリペプチド鎖 (棒状のタンパク質) が複合体 (三量体) を形成しますが、そのα3、α4、α5鎖のいずれかの遺伝子に変異が生じると、そこから産生されるポリペプチド鎖に異常が生じ、形成不全が引き起こされます。4型コラーゲンの遺伝子変異はこれまでに数百種類報告されており、変異によって病態の重症度が異なることがわかっています。アルポート症候群のプレシジョン・メディシンを推進するためには、その原因遺伝子である4型コラーゲンの変異の種類を明らかにし、そこから腎病態の重症度を予測することが求められます。しかしながら、4型コラーゲンの三量体形成能と腎病態の重症度の相関が不明であり、遺伝子変異の種類から、どの程度の腎病態を発症するかを予測することは困難でした。
研究の内容
甲斐教授らは、以前、Split NanoLuciferase (split NanoLuc🄬) による細胞ベースの4型コラーゲン三量体の異常を高感度で検出するシステムを確立しました。本システムは、分割された大小2つのルシフェラーゼ分子 (生物由来の発光分子) の断片をそれぞれ4型コラーゲンα3、α5鎖と融合し、α4鎖と共に細胞に発現させると、α3、α4、α5鎖が三量体を形成できる条件でのみ、化学発光が検出されることに着目した評価系です (図1)。
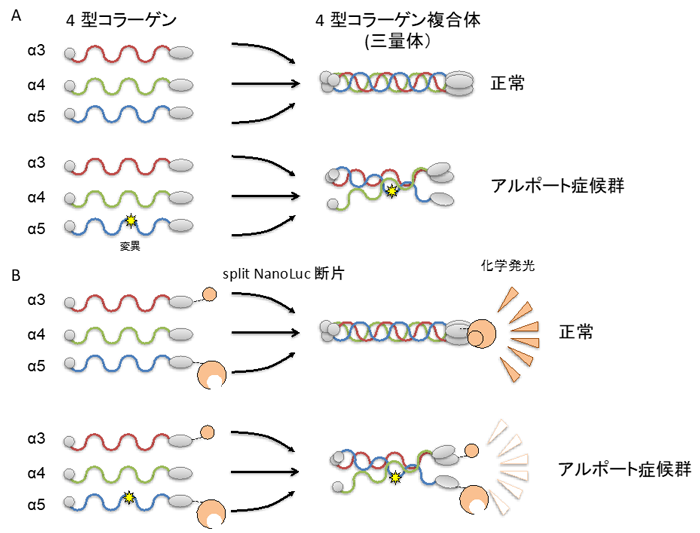
(A) 4型コラーゲンは α3, α4, α5 が上記のように決まった組み合わせで三量体を形成し、基底膜の構成成分となり、正常に機能します。
(B) ルシフェラーゼ分子の断片を融合することで 4型コラーゲンα3, α4, α5 の三量体を発光の強さで測定することができます。
甲斐教授らは、上記の評価系を活用し、病態重症度の異なる4型コラーゲンα5遺伝子の9変異 (重症: G230C、G869R、G1140V、G1149V; 軽症: G509R、G805R、G1000V、G1030S、G1143S) と非病原性と思われる1変異 (G953V) について、細胞内形成三量体及び細胞外分泌三量体の評価を行いました。その結果、重症変異は4型コラーゲンの細胞内形成三量体または細胞外分泌三量体の形成機能とはたらきが著しく低下したのに対し、軽症変異のほとんどは細胞外分泌三量体のわずかな低下に留まっていました。したがって、腎症の重症度の大部分は4型コラーゲン三量体の細胞内形成能及び細胞外分泌能により規定されることが明らかになりました。一方、非病原性と思われる変異 (G953V) コラーゲンでは、三量体の変化がみられなかったことから、本評価系を用いた非病原性・病原性の区別が可能であると考えられました。以上の結果より、Split NanoLuc®による4型コラーゲン三量体評価系が病態重症度の解釈や病原性変異の同定に重要なエビデンスを提供しうることを明らかにしました (図2)。
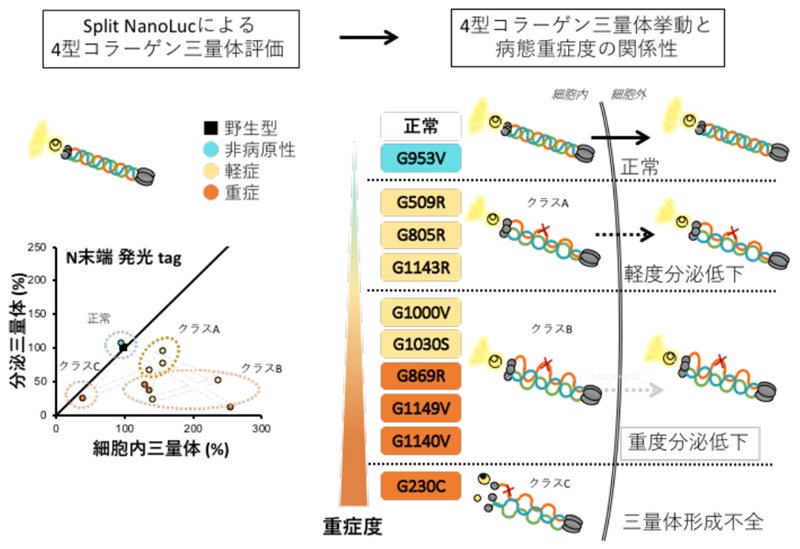
本研究は、アルポート症候群患者の遺伝子の変異情報のみで、腎症の重症度を予測するシステムの構築へと繋げるための基盤的な研究です。今後、アルポート症候群のみならず、さまざまな遺伝性疾患のプレシジョン・メディシンの分野を大きく推進するための、先駆的な研究成果です。
研究支援
本研究は、神戸大学大学院医学研究科内科系講座小児科との共同研究の元行われました。また、本研究は、文部科学省科研費 (JP26460098、JP17K08309、JP19H03379、JP16K19642、JP15K09691、JP17H04189、JP19J15443)、the Alport Syndrome Research Funding Program of the Alport Syndrome Foundation (ASF) and the Pedersen family, Kidney Foundation of Canada (KFOC)、JSPS Program for Advancing Strategic International Networks to Accelerate the Circulation of Talented Researchers (S2803)、熊本大学リーディング大学院 HIGOプログラムの支援を受けて行われました。
論文情報
- タイトル
- “Trimerization and genotype-phenotype correlation of COL4A5 mutants in Alport syndrome”
- DOI
- 10.1016/j.ekir.2020.01.008
- 著者
- Misato Kamura, Tomohiko Yamamura, Kohei Omachi, Mary Ann Suico, Kandai Nozu, Shota Kaseda, Jun Kuwazuru, Tsuyoshi Shuto, Kazumoto Iijima, Hirofumi Kai∗
(∗責任著者) - 掲載誌
- Kidney International Reports