神戸大学大学院医学研究科内科系講座小児科学分野の山村智彦助教、飯島一誠教授、野津寛大特命教授らは、日本人患者におけるアルポート症候群の臨床的特徴に関する大規模な解析を行い、既存の治療法であるACE阻害薬やアンギオテンシン受容体拮抗薬 (RAS系阻害薬) *1はアルポート症候群責任遺伝子 (COL4A5) の遺伝子変異の種類によりその有効性が異なることを明らかにしました。RAS系阻害薬は腎保護作用が認められることから慢性腎臓病に対して広く投与され、アルポート症候群においても有効とされてきました。今回研究者らは日本人アルポート症候群患者において、RAS阻害薬による治療は有効であることを証明すると共に、さらに遺伝子型の違いでその有効性が異なることを世界で初めて示しました。
研究成果は、2020年7月23日 (現地時間) に、国際科学誌「 Kidney International 」にオンライン公開されました。
ポイント
- アルポート症候群は腎炎、難聴、目の合併症 (円錐水晶体や白内障など) を伴う遺伝性の疾患。
- そのほとんどがX染色体連鎖型*2の疾患であるため、特に男性で重症の症状を呈し、なかでもアルポート症候群の原因遺伝子であるCOL4A5に重症型の変異 (ナンセンス変異*3など) を有する場合は20歳代前半で末期腎不全へと至ることが知られている。
- ACE阻害薬やアンギオテンシン受容体拮抗薬 (RAS系阻害薬) による腎保護作用を期待した治療が唯一の治療であるが、これまでの海外からの報告において、尿タンパク減少効果や、腎機能悪化の進行を抑制する効果も示されてきた。
- 本研究チームによる日本人アルポート症候群男性患者における大規模な調査で、RAS系阻害薬により治療が行われなかった群に対し、治療が行われた群では中央値の比較で20年以上末期腎不全進行年齢を遅延させることが分かり、これらの治療が有効であることが示された。
- さらに遺伝子型により軽症型変異 (ミスセンス変異*4など) と重症型変異に分類したところ、重症型変異を有する患者では、RAS系阻害薬による治療は有効ではあったものの、軽症型変異に比較し、その有効性が劣ることが示された。
- このように、遺伝子型によってRAS系阻害薬の有効性が異なることを今回の研究により世界で初めて示した。
研究の背景
アルポート症候群は常染色体優性多発性嚢胞腎 (ADPKD) に次いで2番目に発症頻度の高い遺伝性腎疾患で、海外からは発症頻度は5000人から10000人に1人と報告されています。しばしば腎不全へと進行する腎症、難聴、眼合併症を特徴とし、その遺伝形式にはX染色体連鎖型、常染色体優性、常染色体劣性の3つの遺伝様式がありますが、約80%がX染色体連鎖型です。
X染色体連鎖型アルポート症候群は、4型コラーゲンα5鎖をコードするCOL4A5遺伝子に病的変異を有した場合に発症します。男性患者で特に重症化しやすく、約90%が40歳までに末期腎不全へと進行し、透析や腎臓移植などの腎代替療法が必要になりますが、これまで疾患特異的治療法は存在していません。男性患者においてはCOL4A5遺伝子にナンセンス変異等の重症型の変異を有する場合、ミスセンス変異などの軽症型の変異を有する場合に比較し、10年以上腎不全進行が早いことが知られてきました。ACE阻害薬やアンギオテンシン受容体拮抗薬 (RAS系阻害薬) による腎保護作用を期待した治療が唯一の治療ですが、これまでの海外からの報告において、尿タンパク減少効果や、腎機能悪化の進行を抑制する可能性が示されてきました。
研究の内容
本研究チームはこれまでにアルポート症候群患者に対する網羅的遺伝子診断体制を確立し、日本人患者において遺伝子診断を行ってきました。今回の研究においては、X染色体連鎖型アルポート症候群男性患者430名における臨床的特徴を後方視的に検討しました。その結果、すでに他の研究において報告されている知見も含めて、以下のような知見を得ることができました。
- 臨床データがそろい解析可能な422名での検討の結果、末期腎不全進行年齢の中央値は35歳であった。
- 遺伝子型と末期腎不全進行年齢中央値には非常に強い相関関係があり、ナンセンス変異を有する場合 (図1黒の生存曲線) は18歳でミスセンス変異を有する場合 (図1黄色の生存曲線) は40歳と、22歳の差が認められた (図1)。
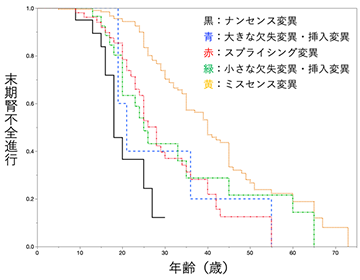
- 難聴を伴う場合と伴わない場合で比較したところ、難聴を伴う場合は末期腎不全進行年齢中央値28歳、伴わない場合は55歳で、難聴を伴う例で明らかに腎症状も重症であった。
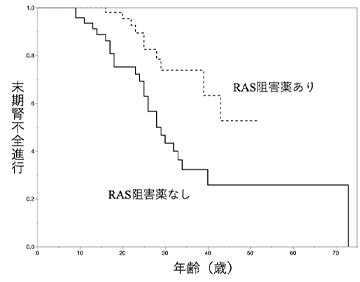
- RAS系阻害薬投与の有無が明らかとなっている患者群計207名で検討を行ったところ、RAS系阻害薬により治療が行われなかった群では中央値28歳で末期腎不全へと至った。一方、治療が行われた群では半数以上が50歳までに末期腎不全へと到達しないことが示され、これらの治療が有効で、中央値の比較で20年以上腎不全進行年齢を遅らせることが可能であることが示された (図2)。
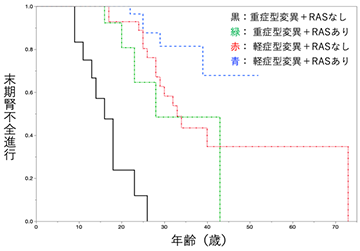
- さらに遺伝子型により重症型変異と軽症型変異に分類し、その有効性を評価したところ、軽症型変異を有する患者では、RAS系阻害薬による治療が行われなかった群 (図3赤の生存曲線) は中央値33歳で末期腎不全に至ったが、治療が行われた群 (図3青の生存曲線) では半数以上が50歳までに末期腎不全へと到達しなかった。一方、重症型変異を有する患者では、RAS系阻害薬による治療が行われなかった群 (図3黒の生存曲線) では中央値16歳で末期腎不全へと至ったのに対し、治療が行われた群 (図3緑の生存曲線) では28歳で末期腎不全へと至っており、重症型変異患者においても有効ではあったものの、その期間は中央値の比較で12年であり、軽症型変異に比較したところ、その有効性が劣ることが示された (図3)。
今後の展開
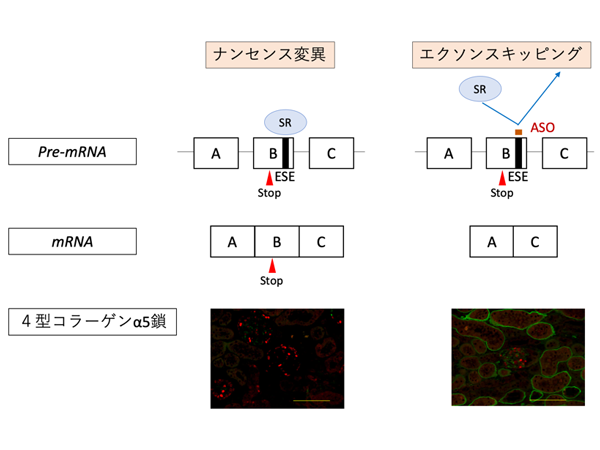
重症型変異を有する患者においてもRAS系阻害薬は有効でしたが、末期腎不全進行年齢中央値はなお、28歳でした。現在本研究チームは重症型変異を有する患者を対象とした治療法 (エクソンスキッピング療法*5) の開発を行っており、今回の研究結果から本治療法の開発への要望はさらに高まると考えられます。
参考: アルポート症候群に対する核酸医薬を用いた新規治療法開発 —難治性遺伝性腎疾患モデル動物に著効することを確認—
用語解説
- *1 ACE阻害薬およびアンギオテンシン受容体拮抗薬 (RAS系阻害薬)
- レニン・アンギオテンシン・アルドステロン系 (RAS系) と言われる、体内において血圧を上げる作用のあるホルモンのいずれかをブロックする作用を有することで降圧効果を発揮する。元来は降圧薬であったが、近年、糖尿病性腎症などの慢性腎臓病に対しても有効であることが証明され、その腎保護作用が示された。
- *2 X染色体連鎖型遺伝性疾患
- X染色体上にコードされている遺伝子の異常により発症する遺伝性疾患。男性はX染色体が1本のみであるため、2本保持している女性に比較し重症の臨床像を呈することを特徴とする。
- *3 ナンセンス変異
- 遺伝子上の塩基配列の異常 (遺伝子変異) のうち、ストップコドンが形成される変異をさす。その場合、ナンセンス変異を有する場所で産生されるタンパクが途切れるため、不完全なタンパクが産生される。一方、同じ遺伝子変異でもミスセンス変異といわれる変異は一つのアミノ酸が他のアミノ酸に置換されるため異常なタンパクが産生されるが、タンパクは途切れず、全長産生される。そのため、XLASにおいてはナンセンス変異を有する場合は最重症の臨床像を呈する。
- *4 ミスセンス変異
- 遺伝子上の塩基配列の異常 (遺伝子変異) により一つのアミノ酸が別のアミノ酸へと置換される変異をさす。その場合、ナンセンス変異と異なり、タンパクは途切れず、全長を有するタンパクが産生される。そのため、遺伝性疾患においてはミスセンス変異を有する場合ナンセンス変異を有する場合よりも軽症の臨床像を呈するものがある。X染色体連鎖型アルポート症候群男性患者においても、そのような遺伝子型と臨床像の相関を強く認める。
- *5 エクソンスキッピング療法
- 核酸医薬を用いてナンセンス変異を有するエクソンを読み飛ばし、軽症型変異へと置換する治療法。現在動物を用いた研究でその有効性を示すことに成功した (Yamamura T et al, Nature Communications 2020)。
謝辞
この研究は2017年4月からは国立研究開発法人日本医療研究開発機構(AMED)の戦略推進部 (難病研究課) 難病性疾患実用化研究事業・希少疾患に対する画期的な医薬品医療機器等の実用化に関する研究・薬事承認を目指すシーズ探索研究 (ステップ0) の支援のもとに継続して参りました。
論文情報
- タイトル
- “Genotype-phenotype correlation and the influence of the genotype on response to angiotensin-targeting drugs in Japanese patients with male X-linked Alport syndrome”
- DOI
- 10.1016/j.kint.2020.06.038
- 著者
- Tomohiko Yamamura1, Tomoko Horinouchi1, China Nagano1, Takashi Omori2, Nana Sakakibara1, Yuya Aoto1, Shinya Ishiko1, Koichi Nakanishi3, Yuko Shima4, Hiroaki Nagase1, Hiroki Takeda1, Rini Rossanti1, Ming Juan Ye1, Yoshimi Nozu1, Shingo Ishimori1, Takeshi Ninchoji1, Hiroshi Kaito1, Naoya Morisada1, Kazumoto Iijima1, Kandai Nozu1
1 Department of Pediatrics, Kobe University Graduate School of Medicine
2 Clinical and Translational Research Center, Kobe University Hospital
3 Department of Child Health and Welfare (Pediatrics), Graduate School of Medicine, University of the Ryukyus
4 Department of Pediatrics, Wakayama Medical University - 掲載誌
- Kidney International