国立大学法人筑波大学 生存ダイナミクス研究センター (TARA) 深水昭吉教授、同 橋本美涼博士 (現 国立大学法人東海国立大学機構岐阜大学 応用生物科学部助教) の研究グループは、マウスを使った解析により、発達中の脳において、生合成されたタンパク質に生じる様々な化学修飾 (翻訳後修飾) の一つである「アルギニンメチル化」が炎症状態の誘導に関与することを見出しました。
本研究の成果は、2020年9月12日付「Journal of Neurochsupistry」で公開されました。
* 本研究は、筑波大学 生存ダイナミクス研究センター (TARA)、岐阜大学、英国 エジンバラ大学医学研究評議会 (MRC) 再生医療センター、神戸大学による共同研究として行われました。 神戸大学からは、大学院医学研究科 細胞生理学分野の遠藤光晴 講師、南 康博 教授が、脳損傷による脳内炎症マウスモデルを用いたPRMT1の発現解析において本成果に貢献しています。
ポイント
- 脳の発達におけるタンパク質翻訳後修飾「アルギニンメチル化注1)」の役割を解明しました。
- アルギニンメチル化の主要酵素PRMT1注2) は脳の炎症誘導を抑え、正常な脳の発達を促している可能性が示されました。
- 本研究グループが開発したPRMT1の脳特異的欠損マウスが、脳の炎症と発達の関係を知る有用なモデルとなり得ることがわかりました。
概要
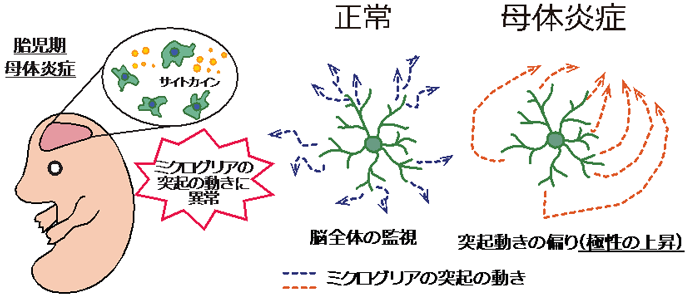
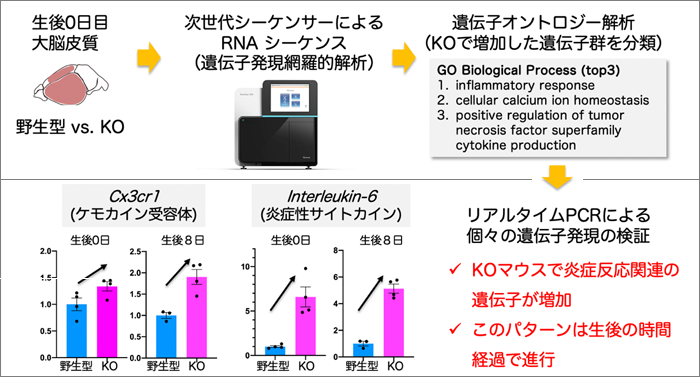
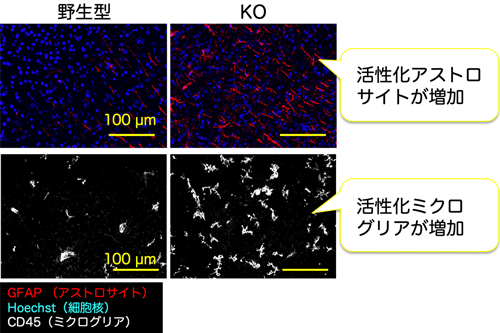
発達期の脳の炎症は、損傷や胎児期の母体の感染等によって引き起こされ、脳の発達に深刻なダメージを与えます。アルギニンメチル化酵素PRMT1の脳特異的欠損マウス (KOマウス) では、ミエリン (神経細胞の髄鞘) 注3) がうまく作られないなど脳が正常に発達せず、生後約2週間で致死となることがわかっていました。本研究では、その原因を調べるため、誕生直後のKOマウス脳の遺伝子発現パターンを網羅的に解析しました (図1)。その結果、KOマウスは炎症関連遺伝子の増加など、既存の脳内炎症モデルと類似したパターンを示しました。さらに、KOマウス脳ではグリア細胞注4) のアストロサイトやミクログリアの異常増加も認められ (図2)、これらは炎症シグナルを介していることが示唆されました。今後、KOマウスが脳の炎症と発達の関係を知る有用なモデルとなることが期待されます。
研究の背景
私たちの体で働く2万種類以上のタンパク質は、様々な化学修飾を受けることで、その機能をスムーズに発揮したり機能を変化させたりしています。化学修飾の一つであるアルギニンメチル化は、まだ不明な点が多いものの、細胞増殖や老化への関与が示されており、近年その重要性が注目されています。
アルギニンメチル化を触媒する酵素PRMT1を全身で欠損したマウスは、胎生期に致死となることから、PRMT1が個体発生に必須であることが知られていました (参考文献1)。本研究グループは、脳の発達におけるPRMT1の機能解析に着手すべく、脳の神経幹細胞注5) において特異的にPRMT1を欠損したマウス (KOマウス) を作製し、解析してきました。これまでの研究で、KOマウスが生後1週間で、ミエリン形成不全を起こし、生後約2週間で致死となることから、PRMT1が脳の発達に必須の酵素であることを見つけていました (参考文献2)。
しかし、PRMT1がどのように脳の発達を制御しているのか、詳しい仕組みは不明でした。また、PRMT1がミエリン以外の脳細胞の発達に与える影響も十分に分かっていませんでした。
研究内容と成果
本研究では、KOマウスが生後1−2週間の脳発達に顕著な異常を示すことから、より早期 (生後0日目=脳の発達途中) のKOマウスを解析対象としました。
まず、KOマウス大脳皮質で起きる分子レベルの変化を捉えるため、RNAシークエンシング解析によって遺伝子発現を網羅的に調べたところ、野生型マウスに比べてKOマウスでは、炎症性サイトカインや炎症を伝達する受容体 (ケモカイン受容体) の遺伝子発現が顕著に増加していました (図1)。変化した遺伝子群を詳しく調べると、既存の脳内炎症モデルに類似した発現パターンを示していることから、KOマウス脳では炎症シグナルが誘導されていることが判明しました。さらに遺伝子発現レベルの継時的変化を見ていくと、炎症状態が生後の脳発達に伴って徐々に強まっていくことも明らかになりました (図1)。
次に、脳組織の解析などから、KOマウス大脳皮質では、活性化注6) 型のアストロサイトやミクログリアが異常に増加していることがわかりました (図2) 。これらはいずれもグリア細胞に分類され、脳損傷をはじめ自閉症や神経変性疾患において活性化型に変化して細胞数も増加し、病態の悪化に関与することが知られています。
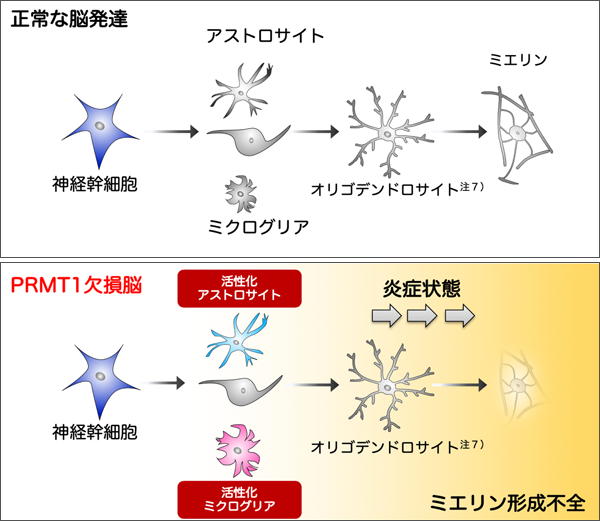
以上より、PRMT1欠損によってグリア細胞が活性化し、炎症シグナルを誘導していることが明らかとなりました。脳内の炎症は、ミエリンや脳自体の発達を阻害する一要因となると言われています。そのため、KOマウスでは、脳の発達中にアストロサイトやミクログリアが活性化して脳内炎症時と同じような環境となり、ミエリンなどの発達に不利な状況を生み出したと考えられます (図3)。
今後の展開
本研究から、PRMT1を欠損すると、神経幹細胞がアストロサイトなどを生み出すステップのどこかで炎症状態を誘導することがわかりました (図3)。今後は、その変化をもたらすメチル化ターゲットの同定により、PRMT1の機能をさらに深く理解できると考えています。
今回用いたKOマウスは、たった一つの酵素の欠損で、グリア細胞活性化を伴う脳内炎症誘導とミエリン形成不全・脳発達異常の特徴を併せ持ち、炎症シグナルが脳の発達に及ぼす影響について調べる有用なモデルとして貢献することが期待されます。
研究資金
本研究は、日本学術振興会の科学研究費補助金 (科研費) :スタート支援 (17H06730:橋本美涼)、若手研究 (20K15913:橋本美涼)、基盤研究 (C) (18K05429:金俊達)、基盤研究 (A) (17H01519:深水昭吉)、稲盛財団、および、三菱財団によって実施されました。
用語解説
注1) アルギニンメチル化
タンパク質の翻訳後修飾の一つ。タンパク質を構成するアミノ酸配列のアルギニンに、メチル基を付加する化学修飾。酵素PRMTファミリー (PRMT1-9) が触媒する。
注2) RMT1
アルギニンメチル化反応を触媒する主要な酵素。protein arginine methyltransferase 1 の略。
注3) ミエリン
髄鞘。神経の軸索に巻きついて絶縁体としてはたらき、素早い神経伝達を可能にする。グリア細胞の1つであるオリゴデンドロサイトの一部がつくる構造。
注4) グリア細胞
脳そのものに豊富に存在する細胞。神経を構造的・機能的に支える役割をもつ。神経幹細胞から生まれるアストロサイトとオリゴデンドロサイト、卵黄嚢から生まれるミクログリアとに大別される。
注5) 神経幹細胞
胎児の脳に豊富に存在し、成長するにつれて神経やグリア細胞を生み出すことで脳が発達する。
注6) 活性化
アストロサイトやミクログリアなどのグリア細胞の性質の変化。細胞体や細胞数が増大し、炎症性サイトカインなどを多く出すようになった状態。脳の疾患や損傷で広く認められる。
注7) オリゴデンドロサイト
グリア細胞の1つ。生後の脳でミエリンを形成することで、神経伝達機能に貢献したり、神経細胞を保護したりする。
参考文献
1) Pawlak, M.R., et al. Mol. Cell. Biol. 20: 4859-4869 (2000)
2) Hashimoto, M., et al. J. Biol. Chem. 291: 2237-2245 (2016)
論文情報
タイトル
“Loss of PRMT1 in the CNS induces reactive astrocytes and microglia during postnatal brain development”
(中枢神経系におけるPRMT1欠損は生後の脳発達においてアストロサイトとミクログリアの活性化を誘導する)DOI
10.1111/jnc.15149
著者
Misuzu Hashimoto, Ayako Kumabe, Jun-Dal Kim, Kazuya Murata, Sowmya Sekizar, Anna Williams, Weizhe Lu, Junji Ishida, Tsutomu Nakagawa, Mitsuharu Endo, Yasuhiro Minami, and Akiyoshi Fukamizu
掲載誌