理化学研究所 (理研) 生命機能科学研究センター動的恒常性研究チームのユ・サガンチームリーダー (理研開拓研究本部Yoo生理遺伝学研究室主任研究員、神戸大学大学院医学研究科客員准教授)、開拓研究本部Yoo生理遺伝学研究室の西田弘大学院生リサーチ・アソシエイト、神戸大学大学院医学研究科細胞生理学部門の南康博教授らの国際共同研究グループ※は、ショウジョウバエ※1 を用いてがん細胞の生死を決める分子機構を解明し、食餌中のアミノ酸の一つを減らすことでがん化に向かう細胞の増殖が抑制されることを発見しました。
細胞のがん化では、ショウジョウバエと哺乳類で共通する分子機構の存在が知られており、本研究成果は、ヒトのがん発生機構の解明や、がんの食餌療法への応用が期待できます。
細胞ががん化する際、「がん遺伝子※2」と呼ばれる遺伝子が活性化※3 し、細胞増殖が促進されます。しかし通常、がん遺伝子が活性化すると細胞死も誘導され、細胞には簡単にがん化しない仕組みが備わっていると考えられてきました。
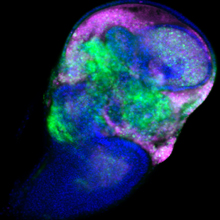
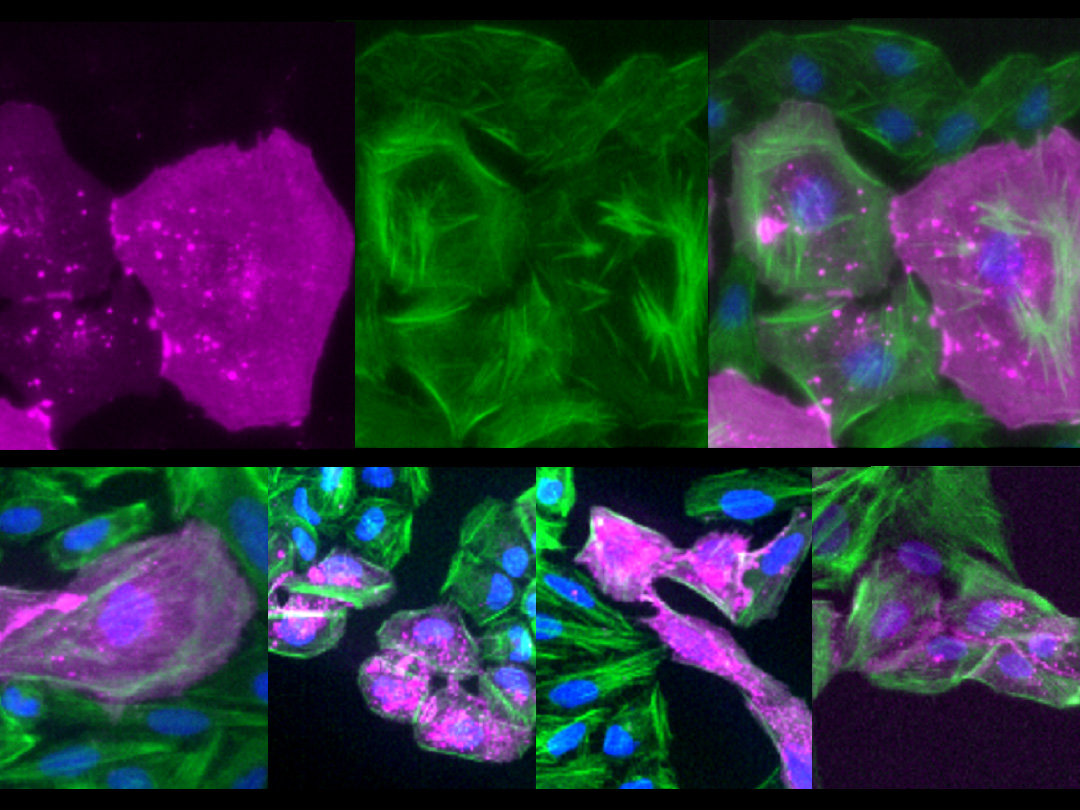
がん遺伝子Srcを発現する細胞は、増殖しつつ (緑)、死ぬ (赤紫) ことが明らかになった。
今回、国際共同研究グループはがん遺伝子Src ※4 に着目し、細胞増殖 (がん化) と細胞死を制御する分子機構を調べました。その結果、Srcは細胞増殖の結果として細胞死を誘導するのではなく、それぞれを独立的かつ同時に駆動していることが分かりました。さらに、食餌中のアミノ酸 (メチオニン) の量を減らすと細胞増殖だけを抑制できたことから、摂取するメチオニンの量を調節することで、がん化を抑制できる可能性が示されました。
本研究は、オンライン科学雑誌『eLife』に掲載されました。
背景
細胞ががん化する際、「がん遺伝子」と呼ばれる細胞増殖を促進する遺伝子が活性化します。しかし、一つのがん遺伝子が活性化しただけでは細胞はがん化しません。なぜなら、多くのがん遺伝子は、活性化すると細胞増殖だけでなく、細胞死も引き起こすからです。これは、細胞が簡単にがん化しないための“フェイルセーフ”の仕組みの一つと考えられてきました。細胞がこの仕組みをすり抜けてがん化するには、一つのがん遺伝子の活性化だけでなく、いくつものがん遺伝子の活性化と「がん抑制遺伝子※2」の不活性化など、多段階のステップが必要です。

対立モデルは、がん遺伝子の活性化により、異常な細胞増殖が起き、その結果として細胞死が引き起こされるという考え方であり、並列モデルは、がん遺伝子の活性化により、細胞増殖と細胞死が互いに独立して引き起こされるという考え方である。
がん遺伝子が細胞増殖に加えて細胞死を引き起こす仕組みとして、従来二つの考え方が提唱されてきました。一つは、細胞死は異常な細胞増殖の結果起こるという考え方 (対立モデル) 、もう一つは、細胞死は細胞増殖とは独立に起こるという考え方 (並列モデル) です (図1) 。しかし、その分子機構が不明であるため、どちらが正しいモデルかという決着はついていませんでした。
今回、国際共同研究グループはショウジョウバエをモデルとして、がん遺伝子Srcを例に、がん遺伝子がどのようにして細胞増殖と細胞死を制御するのかを調べました。
研究手法と成果
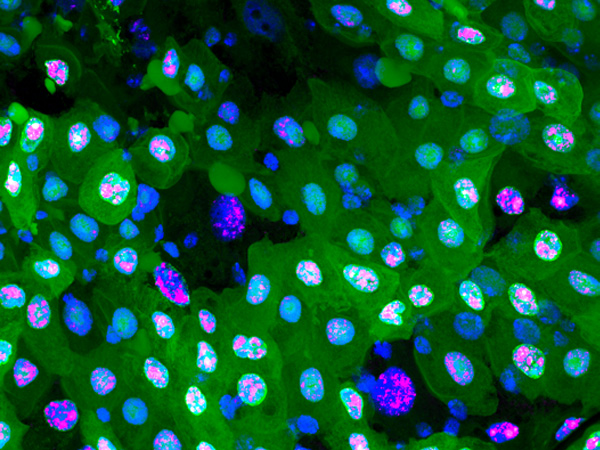
ショウジョウバエの幼虫では、将来成虫の体を構成する組織 (成虫原基) の細胞が増殖・分化しています。がん遺伝子Srcは翅の成虫原基において、細胞増殖と細胞死の両方を誘導することが知られています。国際共同研究グループはまず、Srcによるがん化を再現するため、翅成虫原基でSrcが常に活性化している状況を遺伝子組換え※5 で作り出しました。すると予想通り、Srcが活性化した組織では、細胞増殖に加えて、細胞死も同時に引き起こされることが分かりました (図2)。
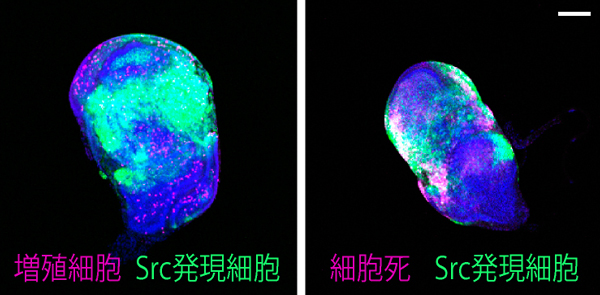
左) ショウジョウバエの翅成虫原基の画像。赤紫は活発に増殖中の細胞、緑は遺伝子組換えにより活性化したがん遺伝子Srcを発現する細胞を示す。両者の重なりは、増殖中のSrc発現細胞を示す。
右) 赤紫は細胞死が進行中の細胞を示す。Src発現細胞では細胞死も誘導されている。スケールバーは100マイクロメートル (μm、1μmは1,000分の1mm)。
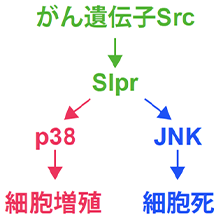
並列モデルに、それぞれの遺伝子産物 (タンパク質) を当てはめた模式図。矢印は細胞内シグナル伝達の流れを示す。Srcは、slprを介して細胞増殖と細胞死を同時に駆動する。slprの下流でSrcのシグナルは二つに分かれ、細胞増殖はp38を、細胞死はJNKを介して起きる。
対立モデルや並列モデルでは、がん遺伝子の活性化に続いて、細胞増殖や細胞死に関わる遺伝子が働くと仮定しています。そこで次に、RNAi法※6 を用いてさまざまな遺伝子の機能を阻害し、細胞増殖や細胞死にどのような影響が現れるかを調べました。その結果、細胞増殖にはp38 ※7 、細胞死にはJNK ※7 というそれぞれ別の遺伝子が重要であることが分かりました。さらに、p38とJNKを同時に活性化するslpr ※7 という遺伝子も見つかりました。
これらのことから、がん遺伝子Srcによる細胞死は異常な増殖に対する反応の結果ではなく、Srcはslpr を中継し、p38を介した細胞増殖とJNKを介した細胞死を並行して同時に駆動することが明らかになりました (図3)。すなわち、対立モデルではなく、並列モデルが実際の細胞で起きていることが分かりました。
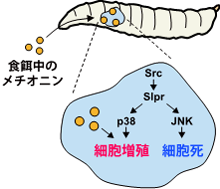
Srcによるp38を介した細胞増殖は、幼虫の摂取したメチオニンの量によって制御される。メチオニンの量を減らすと、p38を介した細胞増殖だけが止まる。
がん治療のアイデアとして、細胞のフェイルセーフの仕組みを利用し、がん細胞の増殖だけを抑制し、細胞死だけを残しておけば、がん細胞が積極的に死ぬという考え方があります。そこで、細胞死には影響せず、細胞増殖だけを止める方法がないか探索しました。p38は個体の栄養状態と細胞増殖をリンクさせる機能も担っていることが知られており、食餌に含まれる栄養素でp38を制御できる可能性が考えられます。幼虫に食べさせる食餌の成分と細胞増殖の関係を調べた結果、食餌中のアミノ酸の一つ、メチオニンの量を減らすことで、p38を介した細胞増殖だけを止められることを見いだしました (図4)。
以上の結果から、がん遺伝子Srcが活性化するとslprが活性化し、その結果、p38が細胞増殖を、JNKが細胞死を促進することが分かりました。また、食餌中のメチオニンを操作することで、p38による細胞増殖だけを抑制することができ、細胞のがん化を抑制できることが分かりました。
今後の期待
がん遺伝子が、細胞増殖に加えて細胞死を促進することはよく知られていましたが、これまでその詳しい分子機構は未知でした。本研究は、ショウジョウバエの成虫原基を用いて、がん遺伝子Srcが細胞増殖と細胞死を同時に駆動することを明らかにしました。細胞ががん化する分子機構は、ショウジョウバエと哺乳類で同じ分子機構が存在することが知られているため、本研究成果は、将来ヒトのがん発生機構の解明にも貢献すると期待できます。
ヒトの多くのがんでも、Srcが活性化していることから、今回のショウジョウバエで発見した分子機構がヒトの細胞のがん化機構にも関わっているのか、また、ヒトにおけるメチオニンと細胞増殖の抑制の関係を調べることが今後の課題です。
補足説明
※1 ショウジョウバエ
ショウジョウバエは、体長2~3mm前後の大きさで、飼育が容易であり、遺伝学的な解析に優れていることから、さまざまな研究分野でモデル生物として用いられてきた。ショウジョウバエを用いたがん研究は歴史が長く、がんの分子機構の解明に貢献している。
※2 がん遺伝子、がん抑制遺伝子
ほとんどのがんは、老化中に遺伝子の変異が蓄積して起こる病気である。遺伝子の本来の機能が亢進する変異 (機能獲得変異) によってがんを引き起こす遺伝子は「がん遺伝子」と呼ばれ、細胞増殖に関わる数多くのがん遺伝子になりうる。反対に、本来の機能が低下・欠損するとがん化を促進する遺伝子を「がん抑制遺伝子」と呼び、細胞増殖のブレーキ役を担うものがこれに含まれる。
※3 遺伝子の活性化
遺伝子は、酵素などのタンパク質を作る情報を持つ。遺伝子の活性化とは、その遺伝子から作られるタンパク質の量が増える、もしくは、タンパク質が通常よりも高い酵素活性を持つことなどを意味する。
※4 Src
歴史上、がん遺伝子として初めて発見された遺伝子。ヒトのさまざまな種類のがんの形成に関わっている。Srcの遺伝子産物はタンパク質リン酸化酵素であり、他のタンパク質をリン酸化することで、その活性を制御できる。Srcタンパク質自身もリン酸化による制御を受け、リン酸化されると不活性型となる。
※5 遺伝子組換え
外来の遺伝子 (DNA) を細胞に導入することで、その遺伝子を発現させたり、細胞が本来持つ遺伝子の機能を操作する技術。本研究では、活性型のSrc遺伝子が翅成虫原基で発現するように設計した組換え遺伝子を用いた。
※6 RNAi法
2本鎖RNAによって配列特異的にRNAが分解される現象をRNAi (RNA interference、RNA干渉) と呼ぶ。この原理に基づいて、短い2本鎖RNAを細胞に導入し、任意の遺伝子の機能を阻害する実験手法をRNAi法という。
※7 p38、JNK、slpr
p38とJNKは、細胞内シグナル伝達因子であるMAPキナーゼをコードする遺伝子。リン酸化されると活性化し、標的タンパク質のリン酸化を介して遺伝子発現を制御する。slprは、MAPキナーゼをリン酸化する酵素 (MAPキナーゼキナーゼ) をリン酸化する酵素 (MAPキナーゼキナーゼキナーゼ) をコードする遺伝子。変異体では発生に異常が生じ、胚がスリッパ (slipper) のような形になることからこの名が付けられた。
研究支援
本研究は、理化学研究所運営費交付金 (生命機能科学研究、開拓研究) で実施し、日本医療研究開発機構 (AMED) の革新的先端研究開発支援事業 (PRIME)「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域における研究開発課題「老化の遺伝学的・非遺伝学的分子基盤の解明 (研究代表者:兪史幹)」、日本学術振興会 (JSPS) 科学研究費補助金若手研究A「個体レベルでの物理的損傷に対する応答・修復メカニズムの解明 (研究代表者:兪史幹)」による支援を受けて行われました。
※ 国際共同研究グループ
理化学研究所
生命機能科学研究センター 動的恒常性チーム
- チームリーダー ユ・サガン (Sa Kan Yoo) (Yoo生理遺伝学研究室 主任研究員、神戸大学大学院医学研究科 客員准教授)
- 研究員 岡田 守人 (おかだ もりひろ) (Yoo生理遺伝学研究室 研究員)
- テクニカルスタッフ 高野 智美 (たかの ともみ) (Yoo生理遺伝学研究室 特別技術員)
開拓研究本部 Yoo生理遺伝学研究室
- 大学院生リサーチ・アソシエイト 西田 弘 (にしだ ひろし) (神戸大学大学院 医学研究科 博士課程)
- パートタイマー (研究当時) リナ・ヤン (Lynna Yang)
神戸大学大学院 医学研究科
生理学・細胞生物学講座 細胞生理学分野・細胞生理学部門
- 教授 南 康博 (みなみ やすひろ)
慶應義塾大学 先端生命科学研究所
- 教授 曽我 朋義 (そが ともよし)
- 助教 (研究当時) 田畑 祥 (たばた しょう) (現 大阪大学蛋白質研究所 特任講師)
ハーバード大学 医学部
- ポストドクトラルフェロー ダイアナ・ホー (Diana Ho)
ソウル大学 生物科学科
- 教授 ジョンキオン・チャン (Jongkyeong Chung)
論文情報
タイトル
DOI
10.7554/eLife.59809
著者
Hiroshi Nishida, Morihiro Okada, Lynna Yang, Tomomi Takano, Sho Tabata, Tomoyoshi Soga, Diana M Ho, Jongkyeong Chung, Yasuhiro Minami, Sa Kan Yoo
掲載誌
eLife