バイオシグナル総合研究センターの乾秀之准教授、公益財団法人ひょうご環境創造協会兵庫県環境研究センターの松村千里主席研究員、昭和薬科大学の山本恵子教授、伊藤俊将教授、大阪大学大学院工学研究科の森直准教授、大阪大学環境安全研究管理センターの中野武招へい教授の研究グループは、毒性化合物であるポリ塩化ビフェニル (PCB) ※1の鏡像異性体 (エナンチオマー)※2ごとの代謝の違いを、動物が持つ薬物代謝酵素の立体構造の観点から明らかにしました。
今後、動物におけるPCBの代謝・解毒経路の推定が可能になるとともに、体内に蓄積し、毒性を示すPCBの鏡像異性体の予測に貢献する技術となることが期待されます。
この研究成果は、7月8日に、国際学術誌Environmental Science & Technology、9月6日に、国際学術誌Chemosphereにそれぞれオンラインで掲載されました。
ポイント
- 過去に製品として製造・使用されていたPCBが、今なお環境や生物に残留している。
- ダイオキシン様毒性を持つPCBの代謝に関する研究は進んでいる。
- キラルPCBの鏡像異性体ごとの代謝に関する研究は進んでいない。
- キラルPCBの二つのアトロプ異性体を分離して、それぞれCYP酵素の基質として用いた。
- 物理的、化学的性質が同じアトロプ異性体間で、代謝の程度は大きく異なっていた。
- CYP酵素のアミノ酸による結合阻害が、アトロプ異性体間で代謝が異なる原因であった。
- 動物の生体内に蓄積しやすいキラルPCBのアトロプ異性体の推測に役立てることができる。
研究の背景
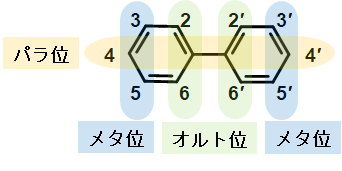
製造や使用が禁止となって50年近く経つPCBは、未だ環境に残存し、食餌を通して生物に取り込まれ、検出されています。PCBの中でも塩素が多く結合するPCBは、水に溶けにくく分解されにくい性質を持つため、生物濃縮により動物の体内に蓄積しやすくなります。体内に高濃度に蓄積すると、健康に悪影響が出ます。PCBの毒性は、アリルハイドロカーボン受容体※3 (AhR) を介して引き起こされ、発がん性、催奇 形性、免疫毒性などのダイオキシン※4の毒性と類似しています。この種の毒性は、特にPCBの基本骨格であるビフェニル環のオルト位に塩素原子が1個置換、または全く置換していないダイオキシン様PCBによって引き起こされることは広く知られ、研究も進んでいます (図1)。一方、ビフェニル環のオルト位に3個以上の塩素が置換するとキラルPCB※5と呼ばれる鏡像異性体となります (図2)。このようなキラルPCBは、ダイオキシン様毒性は示さずリアノジン受容体 (RyR) と結合して神経毒性を示します。キラルPCBに含まれる二つの鏡像異性体 (アトロプ異性体と呼ぶ) は、物理的、化学的に同じ性質を持ち、製品中のPCBには1:1の割合で含まれます。しかし、環境中やミ ミズ、クジラなどの生物、さらにはヒトにおいても偏った比率がしばしば観察されることがあります。この比率の変化は主に代謝によって引き起こされると考えられ、キラルPCBのアトロプ異性体のどちらかが、より代謝反応を受けて、濃度が低下していることを意味しています。
しかしながら、キラルPCBのアトロプ異性体間の代謝反応の違いに関する研究は少なく、代謝酵素の立体構造を基にした議論はほとんどありません。
研究の内容
そこで本研究チームは、シトクロムP450モノオキシゲナーゼ (CYP酵素)※6という代謝酵素に着目して研究を行いました。CYP酵素は動物の体内に入ってきた異物 (食物に含まれている化学物質や汚染物質、摂取した医薬品) と反応し、水に溶けやすい物質に変換する働きがあり、結果として体外への排出を促進します。私たちのこれまでの研究から、CYP酵素はダイオキシン様PCBの水酸化や脱塩素化を触媒することで、AhRとの結合の低下、水溶性の向上による体外排出の促進、その結果解毒につながることを示してきました。すなわち、CYP酵素はPCBが毒性化合物として振る舞うかどうかを決定づける重要な酵素と言えます。そこで、CYP酵素によるキラルPCBの代謝活性の測定、CYP酵素とキラルPCBのドッキングモデルの構築によるPCB代謝物の構造推定、さらにキラルPCBのアトロプ異性体ごとの代謝の違いを決定するCYP酵素の構造について議論することにしました。
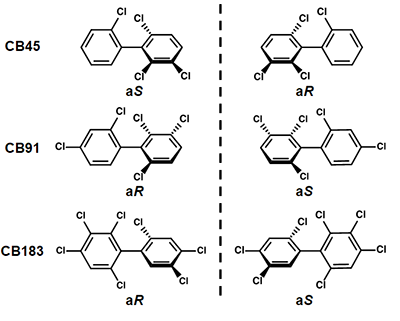
実験材料として、結合する塩素の数が異なるキラル PCBを3種 (4塩素結合するCB45、5塩素結合するCB91、7塩素結合するCB183) を選定しました (図2)。クロマトグラフィーによりキラルPCBのアトロプ異性体をそれぞれ分離し、ヒトが持つCYP酵素の基質として反応させました。アトロプ異性体をそれぞれ分け、反応させた研究はこれまでにありません。その結果、アトロプ異性体ごとに代謝のされ方が大きく違っていることがわかりました (図3)。物理的、化学的な性質が同じアトロプ異性体は、生物的には異なる性質を示すことが明らかとなりました。これらの結果から、キラルPCBのアトロプ異性体の存在比は、片方のアトロプ異性体の代謝が進むことにより1:1から変化する可能性があることがわかりました。 また、(aS)-CB183がより代謝反応を受けることで(aS)-CB183の量が減少すると考えられますが、これはヒトの体内で(aS)-CB183の蓄積量が低いという報告と一致します。
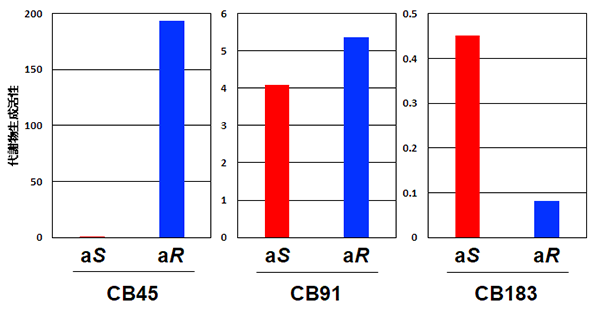
CB45は(aR)-CB45が、CB183は(aS)-CB183がより多く水酸化代謝物に代謝される。CB91では同程度代謝される。
物理的、化学的性質が同じアトロプ異性体がなぜ同じCYP酵素により異なる代謝反応を受けるのでしょうか?この謎を解明するために、CYP酵素の立体構造にキラルPCBのアトロプ異性体をコンピューター上でそれぞれ結合させ、結合のしやすさを調べてみました。その結果、CYP 酵素の中心部にある基質が結合する空洞にアトロプ異性体が収まったとき、空洞を形作るCYP酵素のアミノ酸が結合の邪魔をしていることがわかりました (図4、5)。これにより、結合の邪魔をされないアトロプ 異性体は代謝されやすくなり (CB45の場合(aR)-CB45、CB183の場合(aS)-CB183)、1:1で存在していたキラルPCBのアトロプ異性体の比が変化してしまうことになります。
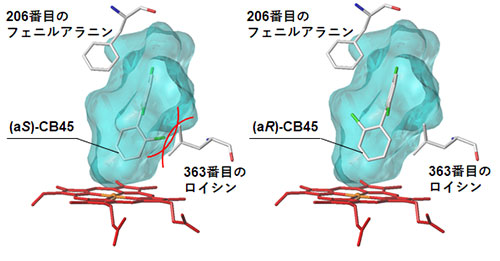
水色の部分はCYP酵素の中心部にある基質が結合する空洞を示す。(aS)-CB45と363番目のロイシンは衝突 (赤線) するため、安定してCYP酵素と結合できず、代謝物の生成活性は下がる (図3参照)。
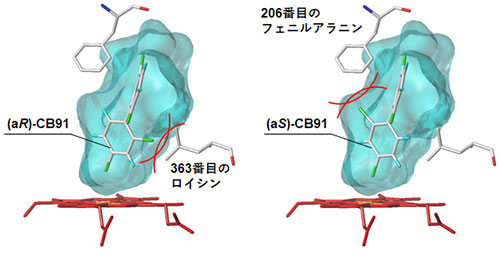
水色の部分はCYP酵素の中心部にある基質が結合する空洞を示す。(aR)-CB91は363番目のロイシン、(aS)-CB91は206番目のフェニルアラニンと衝突 (赤線) するため、代謝物の生成活性は同程度と考えられる (図3参照)。
今後の展開
本研究の成果は、動物の生体内に蓄積しやすいキラルPCBのアトロプ異性体の推測に役立てることができます。すなわち、CYP酵素による代謝反応により、どちらのアトロプ異性体が減少して、その結果どちらの異性体が体内に残留するか推測することができます。キラルPCBの毒性はRyRに結合することにより起こりますが、アトロプ異性体の間で結合の強さが異なります。したがって、キラルPCBの毒性を推測することが可能となります。
用語解説
※1 ポリ塩化ビフェニル (PCB)
ビフェニル環に塩素原子が1から8個結合した化合物の総称で、209種類の構造異性体が存在する。1970年代まで絶縁油として製造され、これを含む製品が利用されていたが、毒性が高いことが明らかとなり、製造・使用が世界的に禁止された。塩素が多く結合したPCBは、分解されにくい性質を示すため、製造・使用が禁止され50年近くたった現在でも、環境や生物中に残存している。
※2 鏡像異性体 (エナンチオマー)
左手と右手の関係にあるような、重ね合わすことができない一対の構造異性体のことで、不斉炭素を持つ化合物は鏡像異性体を持つ。これらは物理的、化学的に同じ性質を持ち、化学的合成では1:1の割合 (ラセミ体) でそれぞれの異性体の混合物となる。
※3 受容体
生物が細胞内に持っている化学物質と結合するタンパク質で、化学物質に応答するために必要な遺伝子の発現を促進、もしくは抑制する役割を持つ。女性ホルモンの受容体として知られるエストロジェン受容体 (ER)、ダイオキシン類が結合するアリルハイドロカーボン受容体 (AhR)、有害アルカロイドの一種リアノジンが結合するリアノジン受容体 (RyR) はこれに含まれ、そのほかにも様々なホルモンに対する受容体が知られている。
※4 ダイオキシン
ゴミなどの低温焼却により発生し、分解されにくい性質を持つため、環境や生物中に長期間残存する。食餌により動物体内に取り込まれたダイオキシンは、細胞内のAhRと結合し、ダイオキシンの解毒に働く酵素の遺伝子の転写を活性化する。
※5 キラルPCB
PCBのオルト位に3個以上の塩素が結合した化合物の総称で、2つのベンゼン環をつなぐ結合の回転が阻害されて、2つの鏡像異性体 (アトロプ異性体) が存在する。19種類のキラルPCBが存在し、それぞれのアトロプ異性体はカーン・インゴルド・プレローグ順位則によりaS、aRと表記される。
※6 シトクロムP450モノオキシゲナーゼ (CYP酵素)
ほとんどの生物が持つ代謝酵素で、生体内の様々な化合物の生合成経路で酸化反応を担うとともに、体内に入ってきた異物を酸化する。これにより、水に溶けやすい構造となり、体外に排泄されやすくなることで解毒へとつながる。
謝辞
本研究は、日本学術振興会科学研究費補助金挑戦的萌芽研究 (25550064)、科学技術振興機構CREST (JPMJCR2001) による支援を受けて行われました。
論文情報
タイトル
DOI
10.1021/acs.est.2c01155
著者
Hideyuki Inui1,2, Terushi Ito2, Chiharu Miwa3, Yuki Haga4, Makoto Kubo5, Toshimasa Itoh5, Keiko Yamamoto5, Masayuki Miyaoka6, Tadashi Mori6, Harunobu Tsuzuki2, Shintaro Mise2, Erika Goto2, Chisato Matsumura4, and Takeshi Nakano7
- 神戸大学バイオシグナル総合研究センター
- 神戸大学大学院農学研究科
- 神戸大学農学部
- 公益財団法人ひょうご環境創造協会兵庫県環境研究センター
- 昭和薬科大学
- 大阪大学大学院工学研究科
- 大阪大学環境安全研究管理センター
掲載誌
Environmental Science & Technology
タイトル
DOI
10.1016/j.chemosphere.2022.136349
著者
Terushi Ito1, Chiharu Miwa2, Yuki Haga3, Makoto Kubo4, Toshimasa Itoh4, Keiko Yamamoto4, Shintaro Mise1, Erika Goto1, Harunobu Tsuzuki1, Chisato Matsumura3, Takeshi Nakano5, Hideyuki Inui1,6
- 神戸大学大学院農学研究科
- 神戸大学農学部
- 公益財団法人ひょうご環境創造協会兵庫県環境研究センター
- 昭和薬科大学
- 大阪大学環境安全研究管理センター
- 神戸大学バイオシグナル総合研究センター
掲載誌
Chemosphere
関連リンク