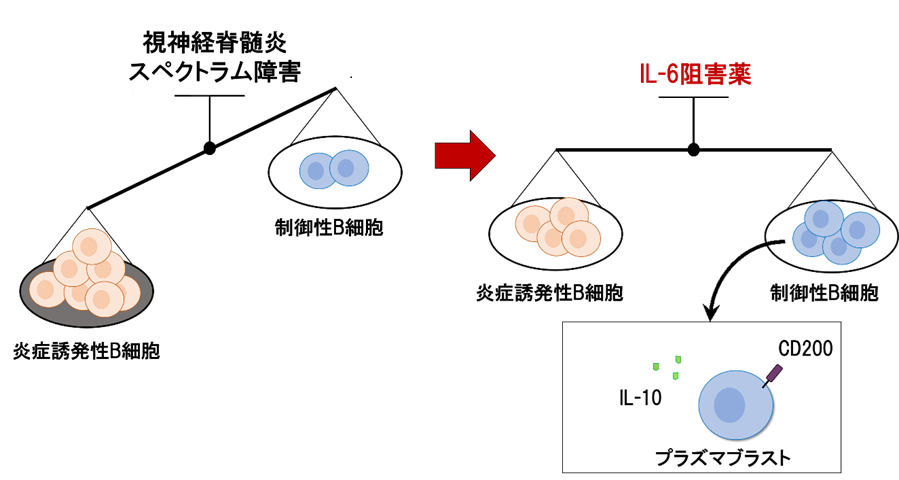
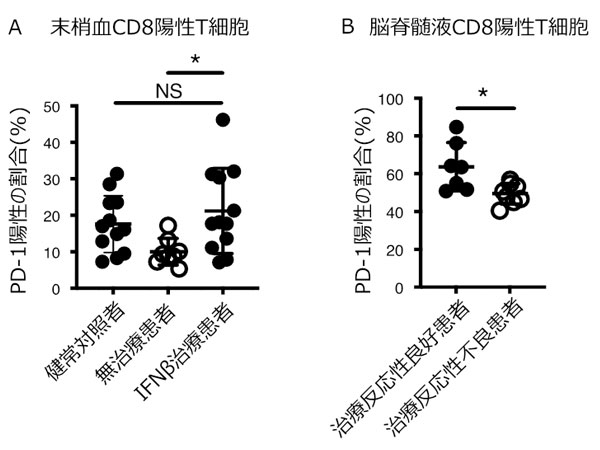
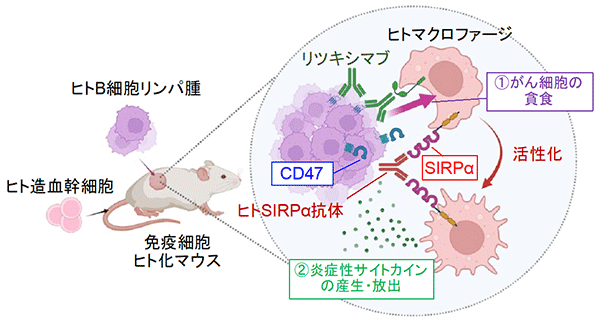
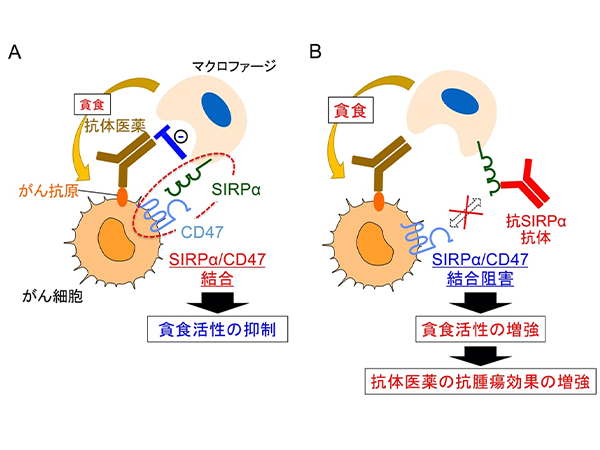
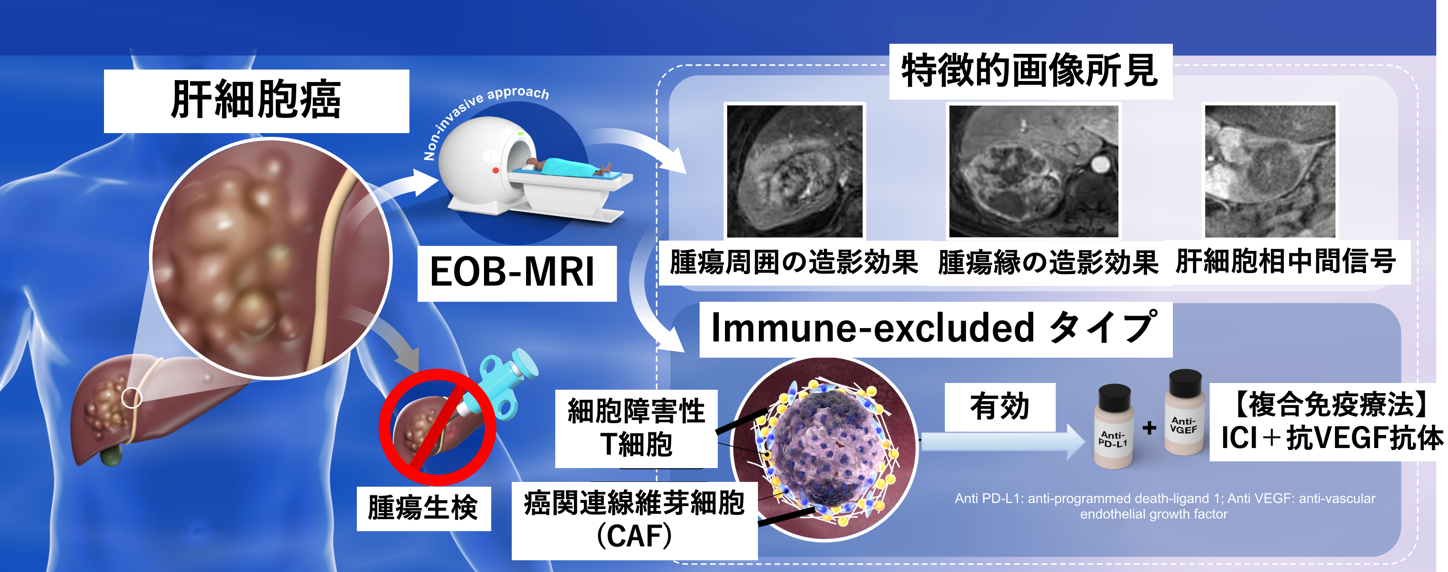
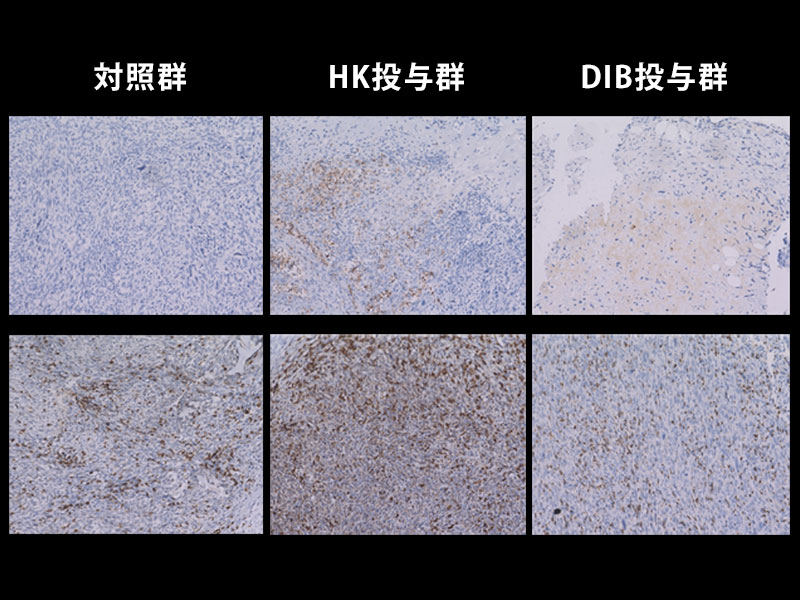
神戸大学医学部附属病院 神経内科学分野の千原典夫助教ら研究グループは、抑制性サイトカインIL-27※1とそのシグナル下流にある転写制御因子※2(Prdm1とc-Maf)が、Tim-3などからなる共抑制性受容体モジュールを誘導し、がん細胞に対する免疫機構である腫瘍免疫をコントロールしていることを発見しました。
この研究成果は、6月21日に国際学術雑誌「Nature」に掲載されました。
研究の背景
CTLA-4やPD-1といった共抑制性受容体はエフェクターT細胞※3に発現して免疫応答の恒常性に関与します。その制御不全は自己免疫疾患を起こし、過剰発現はT細胞疲弊を誘導し慢性ウイルス感染症や癌における免疫回避※4を起こします。しかし、これら抑制性受容体が共発現する分子メカニズムは不明でした。
研究の内容
まずsingle cell RNA-SeqやCytometry by time of flight (CyTOF) といった遺伝子及び蛋白の発現解析手法を用いて腫瘍組織における疲弊T細胞の共抑制性受容体と共刺激性受容体の発現を解析したところ、PD-1、Tim-3、Lag-3、TIGITといった既知の共抑制性受容体に加えて、多くの新たな表面受容体を同定しました。これら共抑制性受容体モジュールは抑制性サイトカインIL-27によって誘導され、腫瘍微小環境のみならず、慢性感染症環境、アナジーや免疫寛容に共通して見られるより大きな共抑制遺伝子プログラムの一部です。我々はその中からactivated protein C receptor (PROCR) とpodoplanin (PDPN) について腫瘍モデルを用いた機能的実証を行いました。さらに、共抑制遺伝子プログラムのコンピューター解析によってPrdm1とc-Mafが協働して共抑制性受容体モジュールを制御していることを明らかにし、これら2つの転写因子が腫瘍に対する免疫応答を抑制する鍵となっていることを示しました。
今後の展開
この研究成果はこれまで明らかになっていなかった疲弊T細胞の共抑制性受容体発現制御の全体像を示し、腫瘍に対する免疫療法の新たな標的を見出したことに加えて、共抑制性受容体発現の鍵となる転写制御因子を同定しました。これにより、腫瘍微小環境のみならず、その制御不全が見られる自己免疫疾患の病態解明にもつながるものと期待されます。
用語解説
※1 IL-27
インターロイキン27。ILはリンパ球などが産生するたんぱく質群(サイトカイン)の一つのグループで、免疫応答の調節に関与する。このうちIL-27はヘルパーT細胞の分化誘導作用と免疫・炎症抑制作用を持っている。
※2 転写制御因子
標的遺伝子に特異的に結合し、その遺伝子の発現を促進、もしくは抑制する。
※3 T細胞
リンパ球の一種。働きによって、ヘルパーT細胞、キラーT細胞など複数種に分類され、免疫反応の促進や、ウイルスなどに感染した細胞への攻撃などを担っている。
※4 免疫回避
腫瘍細胞などが免疫細胞の監視や攻撃から逃れる働き。
謝辞
この研究は上原記念生命科学財団 海外留学助成ポストドクトラルフェローシップを受け、日本学術振興会 海外特別研究員として行いました。
論文情報
タイトル
“Induction and transcriptional regulation of the co-inhibitory gene module in T cells”
DOI
10.1038/s41586-018-0206-z
著者
Norio Chihara, Asaf Madi, Takaaki Kondo, Huiyuan Zhang, Nandini Acharya, Meromit Singer, Jackson Nyman, Nemanja D. Marjanovic, Monika S. Kowalczyk, Chao Wang, Sema Kurtulus, Travis Law, Yasaman Etminan, James Nevin, Christopher D. Buckley, Patrick R. Burkett, Jason D. Buenrostro, Orit Rozenblatt-Rosen, Ana C. Anderson, Aviv Regev & Vijay K. Kuchroo
掲載誌