神戸大学先端バイオ工学研究センターの猪熊健太郎学術研究員、蓮沼誠久教授、大学院科学技術イノベーション研究科の近藤昭彦教授らの研究グループは、出芽酵母Saccharomyces cerevisiaeの細胞表層(細胞壁)に発現させた異種生物由来のタンパク質の局在(立体配置)を人為的にコントロールできることを発見し、その現象を利用して酵素などを酵母の細胞表層に、より効率的に集積させる技術を開発しました。
この研究成果は、酵母の細胞表層に異種タンパク質を集積し機能性を付与する「細胞表層工学」において、「異種タンパク質の立体配置」という全く新しい観点からの改良を可能にするものであり、バイオプロダクションや医療など、細胞表層工学を利用した様々な分野における酵母の機能性強化に貢献できると期待されます。
この研究成果は、11月9日に、国際科学誌「Metabolic Engineering」に掲載されました。
ポイント
- 酵母の細胞壁空間に異種生物由来のタンパク質を固定・集積することで、様々な機能性を付与された酵母を作り出すことができる。
- 酵母の細胞壁に異種タンパク質を固定する際に、そのタンパク質の固定される局在 (立体配置) をコントロールできることを明らかにした。
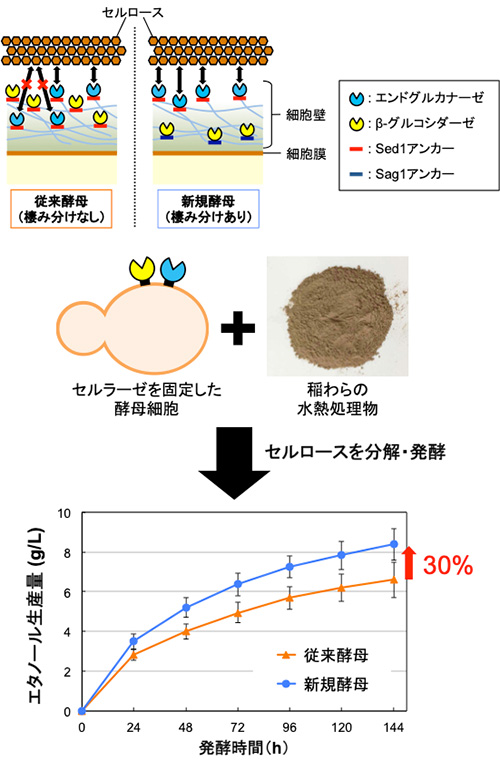
- この局在制御技術を用いて酵母の細胞表層におけるセルロース分解酵素群 (セルラーゼ) の配置を効率化した結果、セルロース分解能力が向上し、植物バイオマス (稲わら) の水熱処理物からのバイオエタノール生産量が約30%向上した。
- 本研究により開発された新技術は、バイオプロダクションや医療など、細胞表層工学を利用した様々な分野における酵母の機能性向上に貢献できる。
研究の背景
酵母はその細胞表層にグルカンの微細繊維が張り巡らされた厚さ100~200 nmの細胞壁を有しています。近藤教授らの研究グループではこれまで、この細胞壁空間に異種生物由来の機能性タンパク質を効率よく固定・集積し、酵母に様々な機能性を付与する「細胞表層工学技術」を開発してきました。この技術を応用可能な分野は多岐にわたり、例えば抗体のライブラリーを固定することで特定の抗原に対して高い結合能を有する抗体医薬品の候補を選別したり、環境汚染の原因物質を吸着するタンパク質を固定することで環境中からその物質を除去したり、植物バイオマスの主成分であるセルロースを分解する酵素群 (セルラーゼ) を固定することで酵母が本来利用することができない植物バイオマスから直接バイオ燃料や化学品を生産可能にするなど、目的に応じた様々な機能性酵母を作り出すことができます。
酵母の細胞壁に異種タンパク質を固定するためには、そのタンパク質に酵母が元々持っている細胞壁タンパク質の一部 (アンカーリングドメイン) を融合させて発現させる必要があります。このアンカーリングドメインには、由来の異なる複数の種類が知られています。これまでの研究から、融合させるアンカーリングドメインの種類によって、細胞壁に固定された異種タンパク質の機能性が著しく変動することが知られていました。しかしながら、なぜそのような違いが生じるのかについては、これまで十分に解明されていませんでした。
研究の内容
これまでの研究から、上記の機能性の変動は、細胞壁の中に入り込むことができない巨大な分子 (例えば不溶性のセルロースなど) を基質とする酵素を固定した場合に特に顕著であることが分かっていました。このことから研究グループは、「融合させるアンカーリングドメインによって、細胞壁空間で異種タンパク質が固定される位置 (局在) に違いがあり、それが細胞外の物質との接触のしやすさ(アクセシビリティ)に影響しているのではないか?」という仮説を立て、それを検証するための比較実験を行いました。
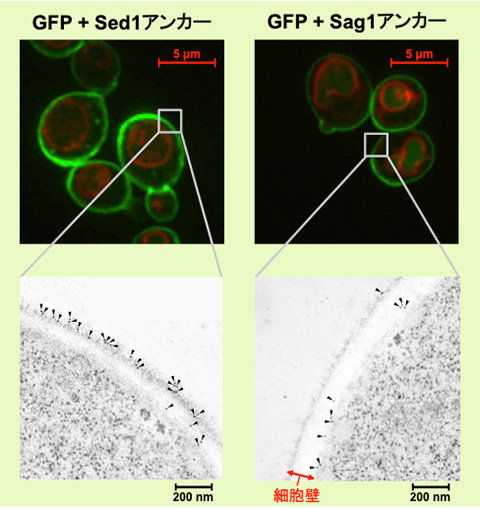
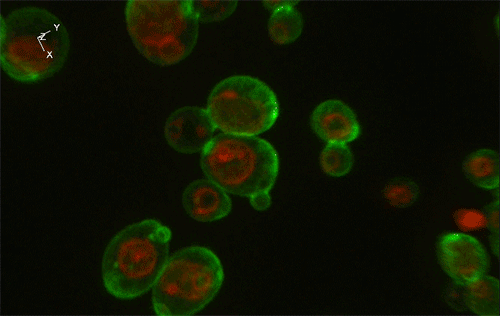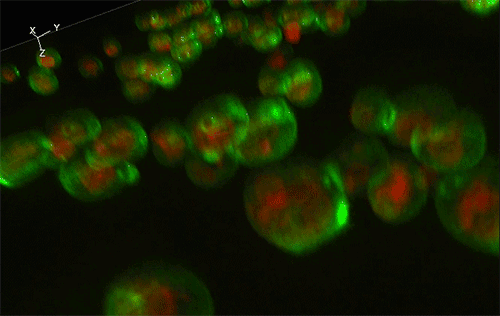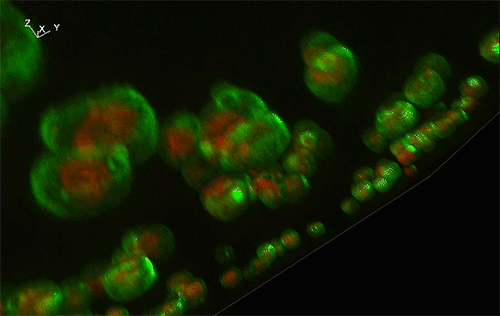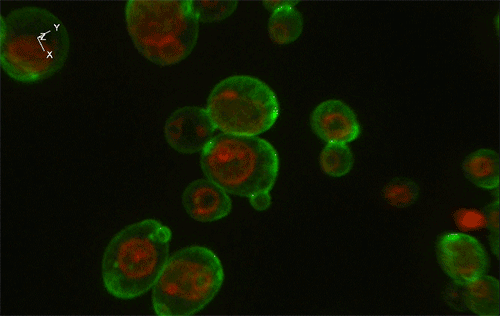
緑色がGFP、赤色が細胞内構造の液胞膜を示す。Sed1アンカーと融合したGFP (左) はほぼすべてが細胞表層に局在していたのに対し、Sag1アンカーと融合したGFP (右) は一部が液胞に局在してしまっており、細胞表層へのGFP輸送効率が低いことが示された。
下段:免疫電子顕微鏡法による酵母細胞壁断面の観察
三角形の先にある黒い点がGFPの局在を示す。Sed1アンカーと融合したGFP (左) は細胞壁の外側に局在する傾向が見られたのに対し、Sag1アンカーと融合したGFP (右) は細胞壁の内側に局在する傾向が見られた。
実験には、出芽酵母Saccharomyces cerevisiaeの細胞表層工学でよく用いられる2種類のアンカーリングドメイン (Sed1アンカーおよびSag1アンカー) を使用しました。これらのアンカーリングドメインを融合させた緑色蛍光タンパク質 (green fluorescence protein: GFP) をそれぞれ酵母で発現させ、共焦点蛍光顕微鏡法※1および免疫電子顕微鏡法※2を用いてGFPの局在を詳細に調べた結果、融合させるアンカーリングドメインによって、細胞表層へのGFP輸送効率だけでなく、細胞壁空間でGFPが固定される位置にも違いがあることが分かりました (図1)。これにより上述の仮説が立証され、また、アンカーリングドメインを使い分けることで酵母の細胞壁における異種タンパク質の局在を人為的にコントロールできることが示されました。
さらに、本研究グループは、上記の実験で判明した局在傾向の違いを利用して、セルロース分解能力を付与された酵母の機能性を強化する実験を行いました。セルロースの分解には、巨大なセルロースの鎖をランダムに切断する酵素 (エンドグルカナーゼ) や、サイズの小さいオリゴ糖をグルコースへと分解する酵素 (β-グルコシダーゼ) など、役割の異なる複数の酵素が関与します。これらの酵素を役割に応じて細胞壁内で立体的にすみ分けさせた新規酵母株を構築し (エンドグルカナーゼを外側、β-グルコシダーゼを内側に配置)、未利用植物バイオマスの一種である稲わらの水熱処理物からのバイオエタノール生産試験を行ったところ、すみ分けを行わなかった従来の酵母株に比べて、エタノールの生産量が約30%向上しました (図2)。
今後の展開
従来の細胞表層工学において、酵母細胞の機能性強化は主に「如何に効率よく、大量の異種タンパク質を細胞表層に固定するか」という観点から行われてきました。今回の研究成果は、「細胞表層における異種タンパク質の立体配置」という、全く新しい観点からの機能性強化を可能にするものです。図2に示したような酵素のすみ分けによるバイオマス分解能力の向上はもちろんのこと、抗体を細胞壁の最外層に優先的に固定することでサイズの大きい抗原に対する接触性を高め、より効率の良い抗体選別を可能にするなど、細胞表層工学を利用した様々な分野における酵母の機能性強化への応用が期待されます。
用語解説
※1 共焦点蛍光顕微鏡法
細胞のような厚みを持った試料を観察する際に、特殊な蛍光顕微鏡を用いることで焦点のあっている位置以外からの蛍光を排除し、ボケのない鮮明な蛍光イメージ (光学的スライス画像) を得る実験手法。蛍光物質が細胞内の何処に存在するのかを数百ナノメートルの解像度で可視化することができるほか、焦点位置を少しずつずらして撮影した複数枚の画像を重ね合わせることで、観察対象の3D画像を得ることもできる。
※2 免疫電子顕微鏡法
標的とする抗原分子を、その抗原に特異的に結合する抗体で標識し、電子顕微鏡を用いて観察する実験手法。抗原分子(この場合はGFP)の局在をナノメートルオーダーの解像度で可視化することができる。
謝辞
本成果は、文部科学省先端融合領域イノベーション創出拠点形成プログラム「バイオプロダクション次世代農工連携拠点」、JSPS 科研費 JP18K05554、およびJSPS二国間交流事業共同研究 (南アフリカ) の研究助成を受けて得られました。
論文情報
タイトル
DOI
10.1016/j.ymben.2019.11.004
著者
Kentaro Inokuma, Hiroki Kurono, Riaan den Haan, Willem Heber van Zyl, Tomohisa Hasunuma, Akihiko Kondo
掲載誌