神戸大学バイオシグナル総合研究センターの酒井恒助教、菅澤薫教授らのグループは、国立医薬品食品衛生研究所、ルーヴァン・カトリック大学 (ベルギー)、京都大学、国立遺伝学研究所の研究者との国際共同研究により、紫外線によって生じるDNA損傷の認識・修復においてユビキチン-プロテアソーム系*1が関与する制御機構を明らかにしました。
ポイント
- 細胞内の任意の場所に紫外線刺激によるDNA損傷を引き起こし、リアルタイムで顕微鏡観察するシステムを構築した。
- さまざまな細胞機能の制御に関わるタンパク質分解酵素複合体プロテアソームが、紫外線によって誘導されるDNA損傷領域に速やかに集まってくることを見出した。
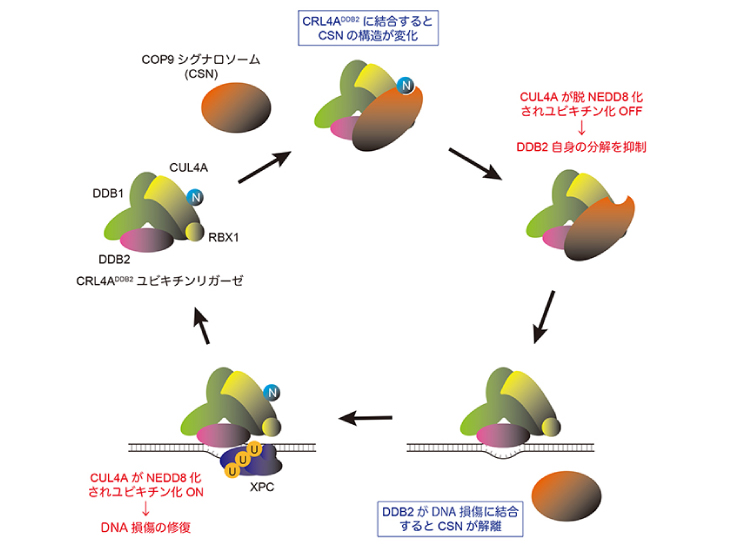
- 色素性乾皮症*2関連因子であるDDB2タンパク質を介したDNA損傷認識経路において、プロテアソームの活性と構造の適切な維持が重要であることを明らかにした。
研究の背景
太陽の光に含まれる紫外線は遺伝子に傷を引き起こすため、生物にとってとても有害です。このような傷は「DNA損傷」と呼ばれます。通常、私たちの細胞の中にはDNA損傷を修復するシステムが備わっているため、太陽の光を毎日浴びても問題なく日常生活をおくれます。しかし、色素性乾皮症 (XP) の患者ではこれらの修復システムに生まれつき異常があるため、紫外線によって生じたDNA損傷をうまく修復できず、太陽の光が当たった部分に皮膚がんを発生しやすいことが知られています。
また、細胞内のタンパク質は必要に応じて作られたり分解されたりしますが、その分解を担当している重要なシステムの一つとして「ユビキチン-プロテアソーム系」が知られています。紫外線によって生じたDNA損傷の修復とユビキチン-プロテアソーム系が細胞内で共同して働くことは以前から指摘されていましたが、その詳しいメカニズムは不明でした。
研究の内容
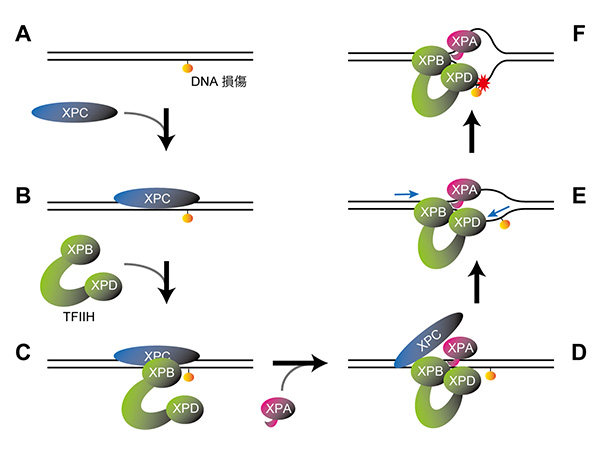
神戸大学バイオシグナル総合研究センターの菅澤グループでは、独自の顕微鏡システム*3を構築することにより、紫外線によって引き起こされるDNA損傷に対するさまざまなタンパク質の動きを生きた細胞で観察することに成功しました (図1左)。
このシステムを利用することで、XPの原因遺伝子産物の一つであり、紫外線によって生じたDNA損傷の認識を担うDDB2タンパク質とユビキチン-プロテアソーム系が共同してDNA修復の促進に関与していることを新たに見出しました。まず、巨大なタンパク質複合体であるプロテアソーム自身がDDB2タンパク質に依存して核内のDNA損傷領域に速やかに集まってくることから、損傷の修復に伴ってタンパク質分解が引き起こされることが示唆されました (図1右)。
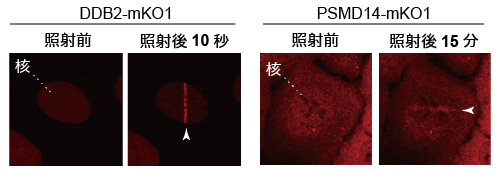
紫外線によって生じたDNA損傷領域に蛍光タンパク質を付加した各因子が集積している (白い矢先)。
さらに、プロテアソームの働きを薬剤で阻害すると、プロテアソーム自身が細胞の核内で巨大な凝集体を形成し、これにトラップされたDDB2タンパク質がDNA損傷修復に関与できなくなることがわかりました (図2)。プロテアソームを構成するサブユニットの発現を抑制して正常なプロテアソームの構築を妨げると、このような凝集体の形成は見られなくなりましたが、一方でDDB2タンパク質のDNA損傷への集まりが著しく抑えられました。これらの結果から、プロテアソームのタンパク質分解活性と、構造体としてのプロテアソームの完全性が、それぞれ別のメカニズムでDDB2タンパク質を介したDNA損傷修復の制御に関わることがはじめて明らかになりました。
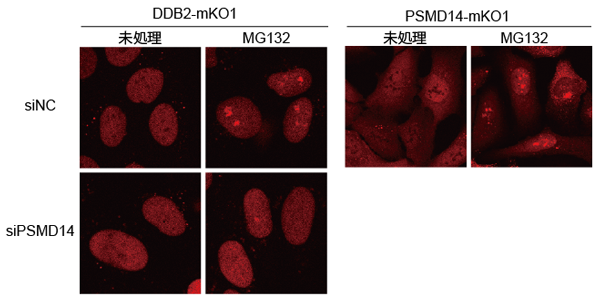
プロテアソームの機能をMG132で阻害すると、DDB2およびプロテアソームのいずれもが核小体周辺で凝集体を形成したが、PSMD14の発現を抑制すると凝集体の形成が抑制された。
今後の展開
DNA損傷の認識メカニズムの働きは、効率の良いDNA損傷の修復を行うためにとても重要です。またその理解は皮膚がんなどの発症メカニズムの解明に貢献するとともに、がんの発症を抑制する薬剤開発に寄与すると期待されます。
用語解説
*1 ユビキチン-プロテアソーム系
ユビキチンと呼ばれる比較的小さいタンパク質を「目印」として付加されたタンパク質は、不要なタンパク質として認識され、巨大なタンパク質分解酵素複合体であるプロテアソームによって分解される。
*2 色素性乾皮症 (しきそせいかんぴしょう、英語名:xeroderma pigmentosum、略称:XP)
常染色体性潜性遺伝疾患であり、海外と比較して日本では患者の頻度が高いことで知られる。紫外線などによって引き起こされるDNA損傷の修復システム (ヌクレオチド除去修復) の異常によって発症する。
*3 独自の顕微鏡システム
共焦点レーザー走査型蛍光顕微鏡をベースとして、紫外線によって誘導されるDNA損傷に対する細胞の応答をリアルタイムで観察できるシステム。波長780ナノメートルのフェムト秒レーザーと三光子吸収と呼ばれる現象を利用して、波長260ナノメートルの紫外線に相当する刺激を導入可能となった。
謝辞
本研究は、日本学術振興会科学研究費補助金・基盤研究(S) (16H06307) の支援を受けて行なったものです。
論文情報
タイトル
DOI
10.1038/s41598-020-76898-2
著者
Wataru Sakai, Mayumi Yuasa-Sunagawa, Masayuki Kusakabe, Aiko Kishimoto, Takeshi Matsui, Yuki Kaneko, Jun-ichi Akagi, Nicolas Huyghe, Masae Ikura, Tsuyoshi Ikura, Fumio Hanaoka, Masayuki Yokoi, Kaoru Sugasawa
掲載誌