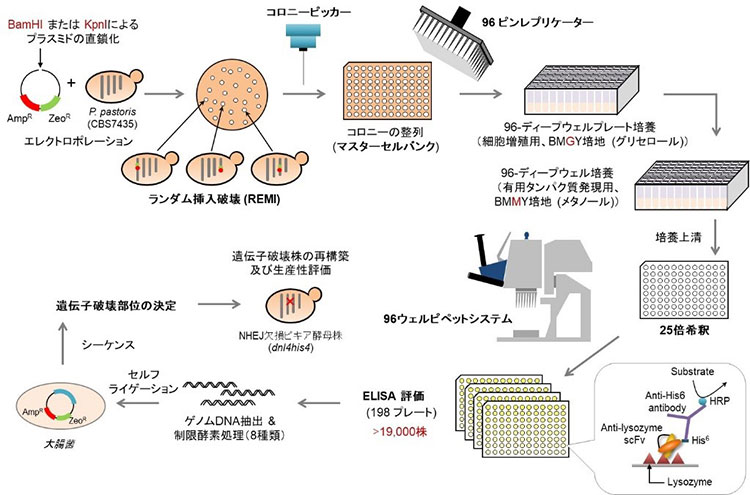
神戸大学大学院科学技術イノベーション研究科の伊藤洋一郎研究員※1・近藤昭彦教授※2、先端バイオ工学研究センターの石井純准教授※3、東京大学大学院新領域創成科学研究科の寺井悟朗特任准教授・浅井潔教授らの研究グループは、タンパク質の生産能力に優れたPichia pastoris (ピキア酵母) 用語解説1内で、RNAの安定性と遺伝子の発現量がターミネーター配列用語解説2によって制御されていることを明らかにしました。
今回の発見により、ターミネーター配列を交換することでタンパク質の発現レベルを細かく調節することが可能となるため、バイオ医薬品の生産やバイオ化学品の発酵生産など、有用物質の生産性を向上させる技術に繋がると期待されます。
この研究成果は、12月1日 (現地時間) に、Nucleic Acids Researchに掲載されました。
※1 高機能遺伝子デザイン技術研究組合 (TRAHED) 研究員
※2 同 神戸拠点・拠点長
※3 同 神戸拠点・副拠点長
ポイント
- ターミネーター配列を交換するだけで、上流に位置するタンパク質 (抗体や酵素など) のピキア酵母内での発現量を10倍以上調節できるようになった。
- プロモーター配列用語解説3とは異なり、Saccharomyces cerevisiae (サッカロ酵母) 用語解説4由来のターミネーター配列が、異種であるピキア酵母においても機能することを明らかにした。
- 3’-非翻訳領域 (3’-UTR用語解説5=ターミネーター配列) におけるmRNA用語解説6の2次構造の安定性とタンパク質の発現量には統計的に有意な相関があることを示した。
研究の背景
近年、バイオ医薬品である抗体や産業用酵素などの有用タンパク質を微生物で生産する試みや、石油化学に頼らないバイオ化学品の発酵生産が世界的に盛んになっています。特にタンパク質の分泌生産能力が高いピキア酵母は、生育も早く、GRAS (Generally Recognized As Safe) に認定されている安全な微生物であることから、産業用のタンパク質生産宿主としての実績が豊富で、様々な化合物生産の宿主としても期待されています。ピキア酵母を用いた有用物質の生産性を向上させるためには、遺伝子の発現をコントロールして、タンパク質量を最適に調節することが重要となります。
これまで、酵母細胞内の遺伝子発現量の調節はプロモーター配列の交換により行われていました。プロモーター配列の交換による遺伝子発現量調節は最小値から数千倍の範囲で可能ですが、細かい発現量の調節には向いておらず、培養条件 (炭素源など) の違いによっても大きく発現量が変化してしまうことが知られています。そこで、サッカロ酵母では培養条件に依存しないと報告があるターミネーター交換による発現量調節をピキア酵母へ応用するため、様々なターミネーター配列をピキア酵母内に導入してその特性を評価しました。
研究の内容
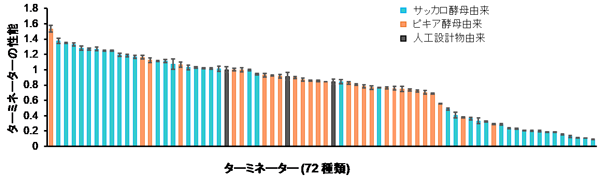
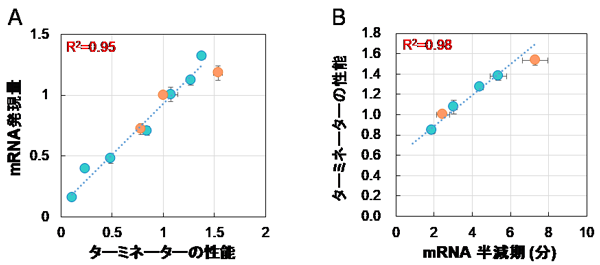
サッカロ酵母由来、ピキア酵母由来、人工設計物由来を含む72種類のターミネーター配列について、ピキア酵母内での性能 (タンパク質の発現量) をそれぞれ評価しました。その結果、ターミネーターの性能はその配列ごとに違いが見られ、最も高い性能のターミネーター配列と最も低いものの差は約17倍ありました (図1)。そのため、ターミネーター配列を交換するだけで、10倍以上のタンパク質発現量の調節ができることが分かりました。
次に、ターミネーター配列の何が目的タンパク質の発現量に影響を与えているのかを検討しました。性能の異なる10種類のターミネーター配列を対象に、ピキア酵母内での目的遺伝子のmRNA発現量とその半減期を評価したところ、mRNA発現量およびその半減期はターミネーターの性能に相関していました (図2)。また、評価に使用したターミネーターの配列から3'-UTRの2次構造の安定性をin silicoシミュレーション用語解説7により算出して評価したところ、ターミネーターの性能と3'-UTRの2次構造の安定性に統計的に有意な相関を見つけることができました。このことから、3'-UTRにおける2次構造の安定性の違いがmRNAの発現量やその半減期に違いをもたらし、その結果、タンパク質発現量に影響していることが示唆されました。
これらの発見は、より強力なタンパク質発現を可能とするターミネーター配列の探索や、人工的に作出した新しいターミネーター配列の設計に繋がると期待されます。
最後に、ターミネーター配列の交換が、産業利用に有効な技術となり得るかどうかを検証しました。モデル系として、黄色素であるベータキサンチンを標的化合物として、チロシンからベータキサンチンへの3段階の合成反応に着目しました (図3A) 。その第1ステップの酵素をコードする遺伝子 (CYP) の下流を10種類のターミネーター配列と交換したピキア酵母株を作製し、ベータキサンチンの生産量を評価しました。その結果、ターミネーターの性能とベータキサンチンの生産量が相関していることが明らかとなりました (図3B)。このデータは、ターミネーターの配列によってCYPタンパク質の発現量が変化するため、結果として、そのタンパク質の発現量と連動してベータキサンチンの生産量が変化したことを示しています。本成果は、ピキア酵母で有用物質の生産量をターミネーター交換によって調節できた世界で初めての実施例です。
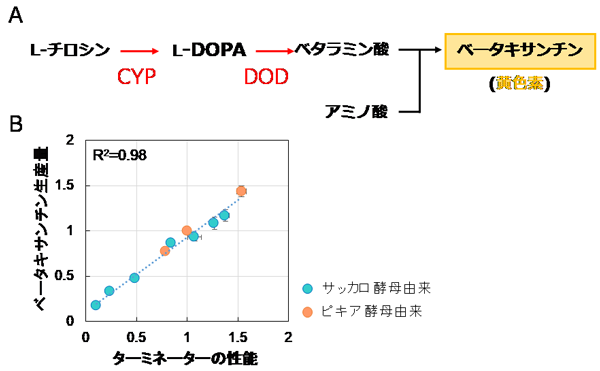
(A) ベータキサンチンの生合成経路。L-チロシンに酵素CYPが作用してL-DOPAへ、また酵素DODによりベタラミン酸が合成される。ベタラミン酸は酵母細胞内のアミノ酸と反応することで、黄色素ベータキサンチンが生産される。
(B) ベータキサンチン生合成量とターミネーター性能の相関図
今後の展開
今回得られた知見を活かし、より強力に発現を調節できる新たなターミネーター配列を開発することを計画しています。これにより、バイオ医薬品やバイオ化学品などさまざまな有用物質の生産性向上を進める予定です。
用語解説
1: Pichia pastoris (ピキア酵母)
ノンコンベンショナル酵母の一種であり、メタノール資化性酵母に分類される。強力なメタノール誘導性プロモーターを用いたタンパク質の分泌生産能力が極めて高い微生物であり、タンパク質生産の宿主として研究だけでなく産業用途にも広く用いられている。
2: ターミネーター配列
タンパク質コード領域 (遺伝子) の下流に位置する塩基配列。転写 (mRNA合成) を終結するための配列と考えられていたが、上流のタンパク質の発現量にも影響を及ぼしていることが近年判明している。
3: プロモーター配列
タンパク質コード領域 (遺伝子) の上流に位置する塩基配列。転写因子とともにmRNA合成の開始に関与している。
4: Saccharomyces cerevisiae (サッカロ酵母)
モデル生物の一つであり、出芽酵母に分類される。酵母の中で最もよく使用されている種属であり、遺伝学や代謝工学など幅広い研究用途に使用されている。ビールやワイン、日本酒などの醸造やパン作りなど、伝統的な発酵産業にも古くから利用されている。
5: 3’-非翻訳領域 (3’-UTR;3 ’-untranslated region)
遺伝子発現時の転写物 (mRNA) で、終始コドンとポリA配列の間に存在する翻訳されない領域。ターミネーター配列部分の一部が相当する。
6: mRNA
伝令RNA (メッセンジャーRNA = mRNA) のこと。mRNAは、タンパク質合成 (翻訳) に必要なコード領域を含むリボ核酸であり、DNAから産生 (転写) される。
7: in silicoシミュレーション
コンピューターによる数値計算やシミュレーションによって、生体分子の性質や動態などを予測する手法のこと。
謝辞
本研究は、国立研究開発法人日本医療研究開発機構 (AMED) 次世代治療・診断実現のための創薬基盤技術開発事業 (バイオ医薬品の高度製造技術の開発) 「バイオ医薬品の多品種・大量製造に適した微生物による高度生産技術の開発」(研究開発代表者:石井 純)、「高性能な国産細胞株の構築」(研究開発代表者:近藤 昭彦)、および一部について国立研究開発法人新エネルギー・産業技術総合開発機構 (NEDO) 植物等の生物を用いた高機能品生産技術の開発事業「高生産性微生物創製に資する情報解析システムの開発」および国立研究開発法人科学技術振興機構 (JST) 未来社会創造事業 (探索加速型「地球規模課題である低炭素社会の実現」領域) 「光駆動ATP再生系によるVmax細胞の創製」の支援を受けました。
論文情報
タイトル
DOI
10.1093/nar/gkaa1066
著者
Yoichiro Ito, Goro Terai, Misa Ishigami, Noriko Hashiba, Yasuyuki Nakamura, Takahiro Bamba, Ryota Kumokita, Tomohisa Hasunuma, Kiyoshi Asai, Jun Ishii*, Akihiko Kondo*
- *Corresponding author
掲載誌