女性の癌のうち最も多いのは乳癌で、その乳癌の中でも最も難治性のものは「トリプルネガティブ乳癌」です。トリプルネガティブ乳癌は、他の乳癌に比べて浸潤・転移しやすく、既知の抗癌剤治療にも抵抗性で、予後が不良となる場合が多いことから、その鍵となる原因分子の早急な解明や新しい治療薬の開発が切望されています。
神戸大学大学院医学研究科分子細胞生物学分野の 西尾 美希 講師らの研究グループは、細胞内シグナルであるHippo-TAZ経路がトリプルネガティブ乳癌の発症・進展の鍵となるドライバー経路であることを明らかにしました。
この発見は難治性乳癌の新しい治療薬の開発につながる可能性があります。
本研究は米国時間7月11日付け (米国時間午後5時) で米国科学アカデミー紀要誌「Proceedings of the National Academy of Sciences」に掲載されました。
研究の背景
乳癌は、世界で1番患者数の多い癌であり、日本でも年間94,400人が新たに罹患する癌である。
組織学的側面から乳癌を分類すると、乳癌には内腔細胞※1の形質をもつ内腔細胞癌と、基底細胞※1の形質をもつ基底細胞様乳癌があるが、内腔細胞癌も基底細胞様乳癌も共に内腔細胞が癌化したものであることが、近年証明されている。しかしながら基底細胞様乳癌は内腔細胞由来であるにもかかわらず、如何にして内腔細胞の形質が消失し、基底細胞様の形質を獲得するかは不明であった。
治療的側面から乳癌を分類すると、乳癌にはエストロゲン受容体、プロゲステロン受容体、HER2 受容体 (ヒト上皮増殖因子受容体2) のどれかが陽性の内腔細胞乳癌と、これら3つの受容体を全くもたないトリプルネガティブ乳癌 (その71~78%が基底細胞様乳癌) があり、トリプルネガティブ乳癌は全乳癌の約20%を占める。
これら3つの受容体があると、ホルモン療法や抗体療法などの分子標的療法で癌を抑制できるが、トリプルネガティブ乳癌はこれらの受容体をもたないため、有効な分子標的療法がなく、また浸潤・転移もしやすいことから、乳癌の中でも最も予後が不良である。それ故、トリプルネガティブ乳癌 (基底細胞様乳癌) の発症・進展の鍵分子の解明と、その研究知見を基にした新たな治療薬開発が望まれている。
基底細胞様乳癌ではp53遺伝子※2の不活化変異が最も多い(84%)ことから、これが基底細胞乳癌発症・進展の鍵分子の1つと考えられていた。しかしながら、p53遺伝子を不活化変異したマウスが基底細胞様乳癌を発症するには長期間を要することから、まだ明らかにされていない他の鍵分子の変化による影響も考えられた。また、基底細胞様乳癌の初期病変におけるp53遺伝子変異の頻度についても不明であった。
さらに、進行した基底細胞様乳癌患者でTAZ※3の活性が高いことは言われていたが、TAZがどの程度基底細胞様乳癌の発症に関わるかや、基底細胞様乳癌の早期からTAZが活性化されているかは不明であった。
研究の内容とポイント
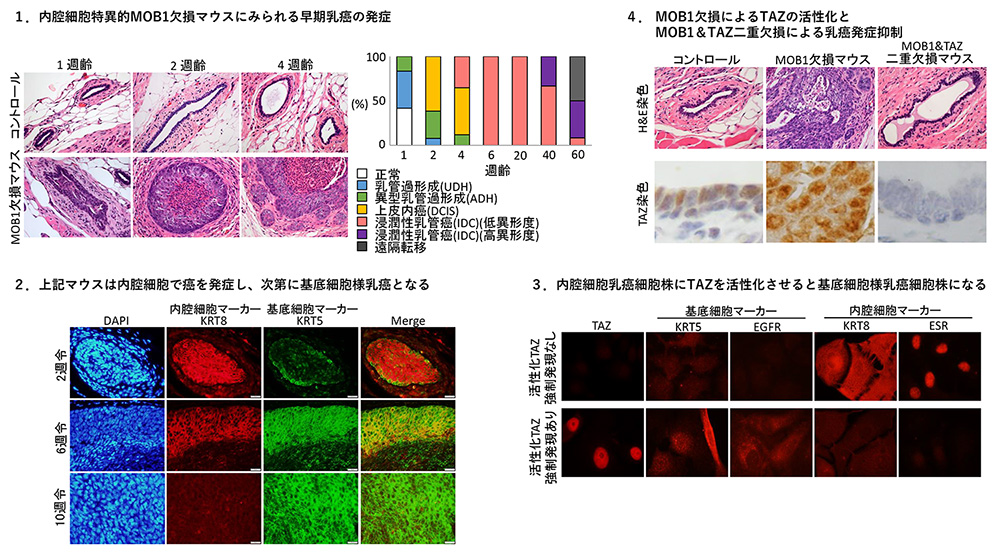
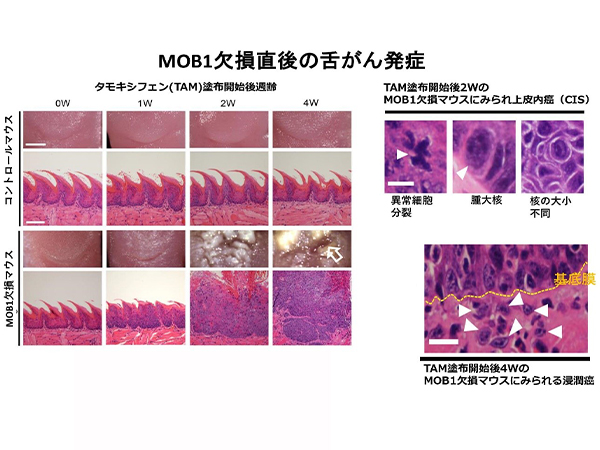
- 乳腺でMOB1※4 (TAZのブレーキに相当) を欠損させ、TAZを強力に活性化させたマウスは、直ちに (2週以内で) 内腔細胞乳癌ができたあと、速やかに基底細胞様乳癌に変化し、4週から浸潤癌を発症した。(図1-1, 図1-2)
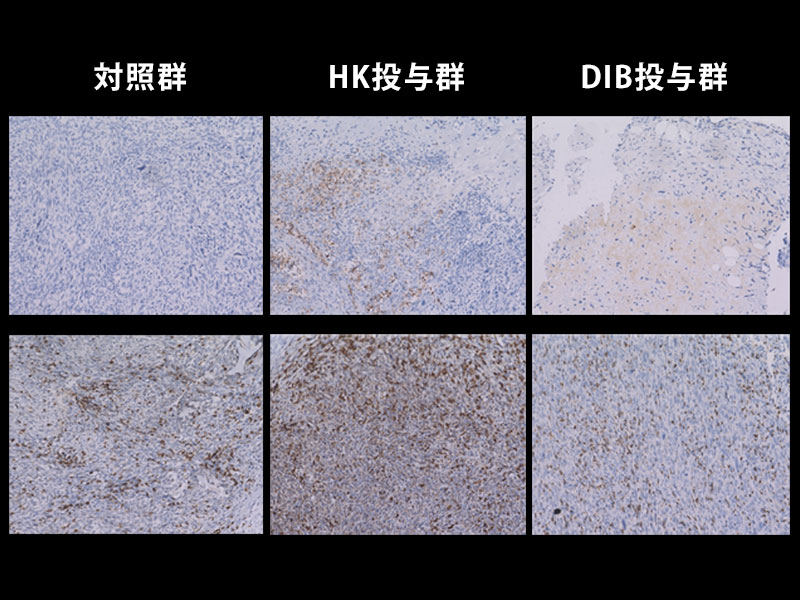
- 試験管内において、ヒト内腔細胞癌細胞株にTAZを活性化させると、基底細胞様乳癌細胞株に変化した。(図1-3)
- MOB1に加えてTAZも二重欠損させたマウスでは、癌の発症が顕著に抑制されることから、基底細胞様乳癌の発症にはTAZ活性化が鍵となることを見出した。(図1-4)
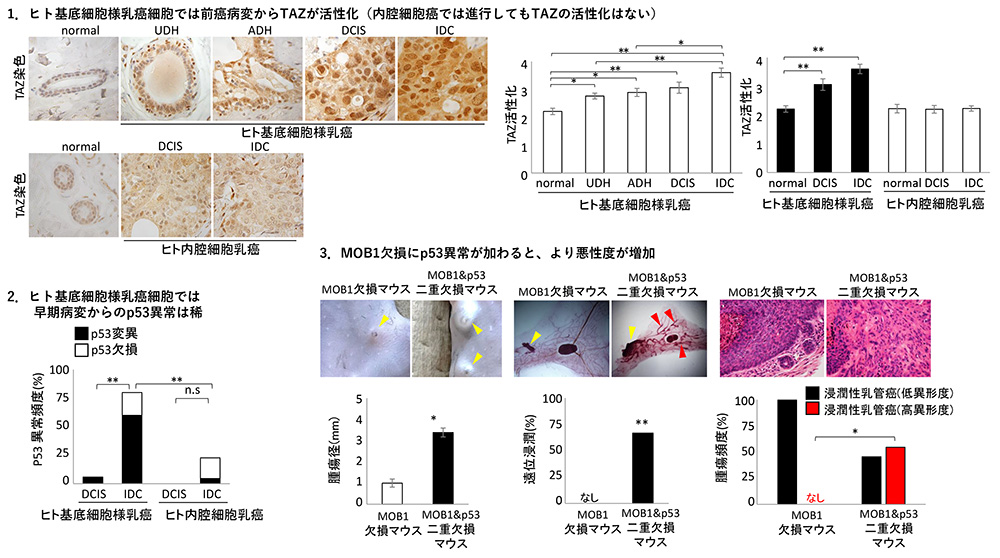
- ヒト基底細胞様乳癌患者では、前癌病変からTAZは既に活性化しており、進行するに従ってTAZはさらに活性化された。基底細胞様乳癌以外のヒト乳癌ではTAZの活性化は見られなかった。(図2-1)
- 基底細胞様乳癌の初期病変の段階でp53遺伝子変異が生じることは稀であったことから、基底細胞様乳癌発症の原因遺伝子はp53ではないと考えられる。(図2-2)
- MOB1欠損 (TAZ活性化) マウスにp53欠損変異がさらに加わると、より進展性や悪性度が高まった。(図2-3)
- 以上の発見から、基底細胞様乳癌発症・進展の鍵分子はTAZであり、ここにp53変異が加わることでさらに悪性度を増すものと考えられた。
考察や今後の展開など
今回TAZの活性化が、トリプルネガティブ乳癌 (基底細胞様乳癌) の発症・進展において重要な鍵となることを始めて見出し、この癌にはTAZを標的とする治療薬が有望である可能性を示した。
これまでに、乳癌発症・進展のリスクファクターである肥満、女性ホルモン、喫煙等や、乳癌で見られるいくつかの遺伝子変異 (p53, WNT1, PI3K, HIF1α/ARNT, EGFR, RTKなど) が、Hippo-TAZ経路の活性を変化させることがわかっている。これらの要因によって閾値を超えたTAZの活性化が持続することで基底細胞様乳癌ができる可能性がある。
現在、本研究グループを含め、世界中の研究者がHippo-TAZ経路阻害剤の開発に凌ぎを削っている。本研究グループの研究が基になって、トリプルネガティブ乳癌の予後が改善する日は遠くないかもしれない。
また、本研究で開発したマウスは、基底細胞様乳癌を極めて早期に自然発症することから、個体レベルでの癌治療薬効果判定に有用となる。そのため、本マウスを使用することで、速やかな阻害剤開発が進められることが期待できる。
用語解説
- ※1 内腔細胞と基底細胞
- 乳管を構成する細胞。乳管は、乳汁を分泌して輸送する内腔細胞と、それを取り巻く基底細胞からなる。
- ※2 p53遺伝子
- 最も代表的な癌抑制遺伝子の1つ。
- ※3 TAZ
- 細胞増殖などに重要な遺伝子の転写 (発現) を亢進させる転写共役因子 (すなわちTAZの活性が高いとより細胞が増殖する)。
- ※4 MOB1, Hippo複合体
- MOB1はHippo複合体のコア分子の1つで、Hippo複合体はTAZ活性化のブレーキとして作用する (すなわちHippo複合体の1つであるMOB1を欠損すると、強力にTAZが活性化される)。
謝辞
本研究は、AMED次世代がん医療創生研究事業(P-CREATE)「癌抑制遺伝子を標的とする癌治療法の開発」や科研費(基盤研究A)「癌抑制ドライバー経路の制御機構」の支援を得て、研究を遂行したものです。
論文情報
- タイトル
- “Hippo-TAZ signaling is the master regulator of the onset of triple negative basal-like breast cancers”
- DOI
- 10.1073/pnas.2123134119
- 著者
- Hirotoshi Soyama*, Miki Nishio*, Junji Otani, Toshiko Sakuma, Shintaro Takao, Shigeo Hara, Takaaki Masuda, Koshi Mimori, Shinya Toyokuni, John P Lydon, Kazuwa Nakao, Hiroshi Nishina, Takumi Fukumoto, Tomohiko Maehama† and Akira Suzuki†
*First equal contribution
†Corresponding authors - 掲載誌
- Proceedings of the National Academy of Sciences, in press