神戸大学バイオシグナル総合研究センターの菅澤 薫教授と情報・システム研究機構 国立遺伝学研究所の花岡文雄所長、米国国立衛生研究所のWei Yang博士らの研究グループは、紫外線や化学発がん物質などによって生じる様々なDNA損傷を修復する過程で、修復の失敗を防いでいる精巧な分子メカニズムの解明に成功しました。今後、がんをはじめとする様々な疾患を防いでいるDNA修復機構のさらなる理解につながることが期待されます。
この研究成果は、4月19日に、Nature誌に掲載されました。
ポイント
- XPCタンパク質はDNAの様々な構造異常を感知するセンサーとして働く。
- 基本転写因子TFIIHとXPAタンパク質が、実際に修復すべきDNA損傷が存在するかどうかを確認することで、DNA修復の正確性が保証される。
- TFIIHに含まれるXPB、XPDタンパク質が「モーター」としてDNAを両方向から引き込み、その動きが妨げられた時にDNA損傷の存在が確認される。
- XPA、XPB、XPDといった色素性乾皮症の原因遺伝子産物について、これまで不明だったDNA修復機構における機能とメカニズムの詳細が明らかになった。
研究の背景
私たちのゲノムDNAは、活性酸素などの内的要因、紫外線・放射線・化学物質などの外的要因によって絶えず傷つけられています。DNA損傷を放置すると突然変異や細胞死を引き起こし、やがてがんをはじめとする様々な疾患の発症につながる可能性があります。このような事態を防ぐための防御機構として、私たちの細胞にはDNAの傷を見つけて修復するための様々なメカニズムが備わっています。
ヌクレオチド除去修復(NER)は、紫外線や化学発がん物質によって生じる幅広いDNA損傷を治すことができる重要な修復機構です。色素性乾皮症(XP)の患者の多くはNERで働くタンパク質の遺伝子に変異があり、NERが正常に働かないため、特に紫外線による皮膚がんを発症しやすいことで知られています。このことからも、NERが発がんに対する防御機構として働いていることがわかります。
NERでは、まずXPの原因遺伝子産物の一つであるXPCタンパク質が、DNAの構造異常を見つけ出す「センサー」として働きます。XPCは非常に幅広い損傷に対応できる反面、例えばDNAの塩基の組み合わせの間違い(ミスマッチ)など、実際には損傷がないところにも結合してしまう性質があります。そのような場所で無用な修復反応が進んでしまうと、かえって突然変異を引き起こす危険があるため、実際に修復すべき損傷が存在するかどうかを確認することが非常に重要です。この損傷確認のステップに基本転写因子TFIIHとXPAタンパク質が関わることが以前から示されていましたが、その詳しいメカニズムは明らかになっていませんでした。
研究の内容
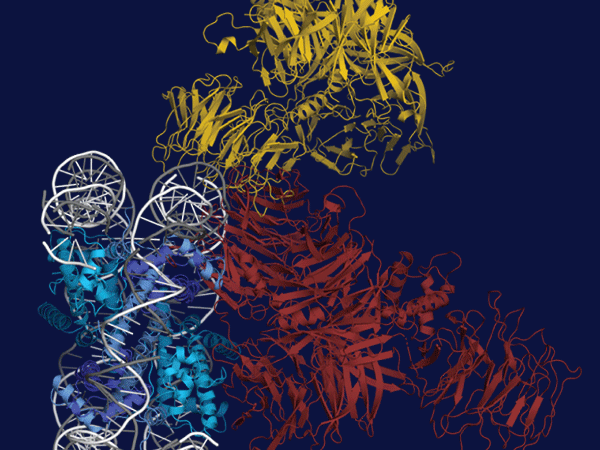
今回、研究グループは、既にわかっているNERの反応ステップに沿って、損傷を含むDNAにXPC、TFIIH、XPAが順次結合した複合体を調製し、それらの分子構造をクライオ電子顕微鏡法により詳細に解析しました。ここで用いたTFIIHはXPB、XPDタンパク質を含む7種類のタンパク質によって構成される大きな複合体で、NERだけでなく転写 (遺伝子発現) にも必要とされる非常に重要な因子です。TFIIHは通常、馬蹄形 (U字形) の構造を取っており、開いた二本の腕の先端にXPB、XPDタンパク質がそれぞれ配置されています。損傷DNA、XPC、TFIIHから成る複合体では、TFIIHは馬蹄形の構造を保っており、XPBを介して損傷部位のXPCと結合する一方で、XPDはDNAやXPCと接触していませんでした (図1C)。ところが、ここにさらにXPAが加わると、TFIIHの構造が大きく変化することがわかりました。開いていた馬蹄形の両腕の部分が閉じて環状になると同時に、XPBと損傷との距離が少し離れ、その間にできたスペースでXPDがDNAと結合していました (図1D)。
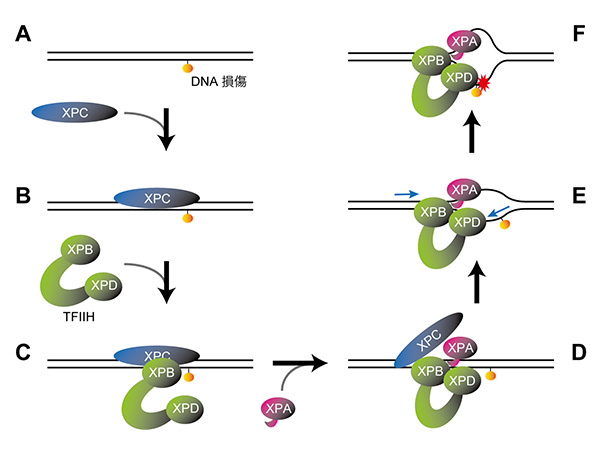
それでは、ここからDNA損傷の存在がどのようにして確認されるのでしょうか? XPBはDNAの二重らせんに結合した上で、DNAの一方の鎖に沿って移動する性質を持つことが知られています。今回明らかになった構造から、XPBはDNA上を損傷から離れる方向に移動すると予想されました。ただし、他のタンパク質と結合しているために実際にXPB自身が移動することはできず、逆にDNAの方が動いて複合体の方に引き込まれます (図1E)。この時、XPAの一部がDNAの二本の鎖の間に挿入されており、あたかもファスナーを開くように二重らせんがほどけて一本鎖の状態になることがわかりました。さらにXPDは一本鎖状態のDNAに結合して、ある決まった方向 (5'→3') に移動する性質があります。XPBとXPAによってほどかれた二本の鎖のうち、XPDは損傷を含むDNA鎖と結合していましたが、XPBと同様にXPD自身が移動することはできないため、やはりその損傷鎖が複合体の方に引き込まれます (図1E)。XPDがDNAと結合する部分は非常に狭い穴のような構造になっており、DNA鎖はその穴をくぐって移動しますが、損傷でDNA鎖の構造が大きく変わっているとその部分が穴の入り口に引っかかって止まってしまいます (糸の結び目が針穴を通らないイメージ:図1F)。このXPDを通したDNA鎖の移動が止まるかどうかで損傷の有無が確認され、修復反応を進めるかどうかを最終判断しているというメカニズムの詳細が今回の研究で明らかになりました。実際、XPDの穴を通過できると予想される比較的軽微な損傷 (塩基の脱離など) は、NERによる修復の対象にならないことが過去の研究で示されています。
今後の展開
今回の研究から、NERによるDNA損傷の修復過程で、XPA、XPB、XPDといったタンパク質のどの部分が、どのような働きをしているかが詳しく明らかになりました。XPの患者で起こっている変異によってこれらのタンパク質に引き起こされる構造変化が、修復反応にどのような悪影響を及ぼして症状の発現につながっているのか、理解が格段に進むとともに、将来的には創薬などの治療法の開発にも貢献できる可能性があります。特に我が国ではXPAに変異を持つXPの患者の割合が圧倒的に高く、タンパク質の構造と機能の関係について理解が進むことは非常に大きな意義があります。
用語解説
色素性乾皮症 (XP)
ヒトの潜性遺伝疾患で、日光に対する皮膚の過敏症状と皮膚がんの好発を特徴とする。XPの患者は8種類の原因遺伝子のいずれかに変異を持ち、このうちXPA~XPGの7種類の遺伝子の塩基配列情報をもとに合成されるタンパク質 (XPA~XPGタンパク質) はすべてヌクレオチド除去修復 (NER) の反応に直接関わっている。日本国内では難治性疾患に指定されており、そのうちXPA遺伝子に変異を持つ患者が半数以上を占める。
クライオ電子顕微鏡法
生体試料を低温 (通常は液体窒素の温度であるマイナス196度) において解析することで、従来の透過型電子顕微鏡に比べて電子線による試料の損傷を大幅に低減し、より生体内に近い状態を保ったまま高精細な構造を観察できる手法。2017年のノーベル化学賞の授賞対象となった。
謝辞
本研究は、日本学術振興会科学研究費補助金・基盤研究(S) (JP16H06307) 及び基盤研究(B) (JP21H03598) の支援により実施されました。
論文情報
タイトル
“Lesion recognition by XPC, TFIIH and XPA in DNA excision repair”
DOI
10.1038/s41586-023-05959-z
著者
Jinseok Kim, Chia-Lung Li, Xuemin Chen, Yanxiang Cui, Filip M. Golebiowski, Huaibin Wang, Fumio Hanaoka, Kaoru Sugasawa, and Wei Yang
掲載誌
Nature